Palliatieve zorg bij (indicatie) COPD
Uitgangsvraag
Wat is palliatieve zorg bij (gevorderde) COPD en op welke wijze worden mensen met COPD met palliatieve zorgbehoeften geïdentificeerd?
Methode: evidence-based
Aanbevelingen
Bij mensen met COPD (alle aanbevelingen niveau 1):
- Zet palliatieve zorg in als er sprake is van twee of meer van de volgende factoren:
- het antwoord ‘nee’ op de ‘surprise question’: ‘Zou het mij verbazen wanneer deze patiënt in de komende 12 maanden komt te overlijden?’
- klachten en/of problemen op lichamelijk, psychisch, sociaal en/of spiritueel gebied die ondanks optimale ziektegerichte behandeling onacceptabel zijn voor de patiënt en leiden tot afname van kwaliteit van leven
- slechte lichamelijke toestand (ernstige beperking in activiteiten, ADL-afhankelijkheid, Karnofsky performance status ≤ 50)
- ondergewicht, vastgesteld door middel van de volgende factoren:
- lage BMI (<21 kg/m2) en/of
- ongewenst gewichtsverlies van >5% in de laatste 6 maanden of >10% over een langere periode (>6 maanden) en/of
- lage vetvrije massa-index (VVMI, mannen <17 kg/m2, vrouwen <15 kg/m2)
- ernstige dyspneu (MRC-score 5: te dyspnoïsch om uit huis te gaan of dyspneu tijdens aan- en uitkleden)
- FEV1 <30% van voorspeld
- (start) chronisch gebruik van zuurstof of thuisbeademing
- één of meer ziekenhuisopnames vanwege een longaanval per jaar
- ernstige comorbiditeit (bijvoorbeeld cor pulmonale, hartfalen, nierinsufficiëntie, diabetes mellitus, kanker)
- ‘mijlpalen’ zoals:
- arbeidsongeschiktheidsverklaring
- ziekenhuisopname met (niet-invasieve) beademing
- afwijzing voor longtransplantatie of bronchoscopische of chirurgische interventies ter vermindering van hyperinflatie
- overbelaste mantelzorger
- noodzaak tot verhuizing of aanpassing van de woning.
- Besteed aandacht aan alle dimensies van het ziek zijn: fysiek, psychisch, sociaal en spiritueel. Ga daarbij uit van een interdisciplinaire benadering. Verleen basale palliatieve zorg op al deze gebieden. Signaleer tijdig klachten en problemen waarvoor consultatie en/of verwijzing noodzakelijk is.
- Voer regelmatig (ten minste jaarlijks en zo nodig vaker) een gesprek om (het begrip van) de situatie, de (gezondheids)vaardigheden en de wensen van de patiënt en diens naasten te evalueren. Ga tijdens het gesprek in op de symptomen en de betekenis daarvan voor het fysiek, psychisch, sociaal en spiritueel functioneren. Besteed daarbij ook aandacht aan de ziektelast. Maak hierbij zo nodig gebruik van meetinstrumenten (bijvoorbeeld Ziektelastmeter COPD, COPD Control Questionnaire (CCQ) of de COPD Assessment Test (CAT)). Exploreer gedachtes en wensen van de patiënt ten aanzien van de toekomst en behandeldoelen. Bespreek, indien mogelijk en gewenst, de prognose.
- Zet ziektegerichte behandeling (waaronder zuurstoftherapie ter verlenging van de overleving, niet-invasieve beademing en medicamenteuze behandeling (meestal bronchusverwijders, inhalatiecorticosteroïden en/of antibiotica)) gericht op verlichting van symptomen zo lang mogelijk door.
- Zet symptoomgerichte palliatie in als de klachten voor de patiënt onacceptabel zijn en/of als er klachten of problemen op psychisch, sociaal of spiritueel gebied zijn ondanks optimale ziektegerichte behandeling.
- Let bij palliatie in de stervensfase op belastende symptomen en signalen en richt het handelen vooral op comfort en verlichting van lijden en verbetering van de kwaliteit van sterven.
- Betrek de mantelzorger en naasten actief in de zorg. Besteed aandacht aan de (gezondheids)vaardigheden, draagkracht, draaglast, waarden, wensen en behoeften van de mantelzorger en naasten, zowel tijdens het ziekteproces als na het overlijden.
- Raadpleeg zo nodig de andere richtlijnen palliatieve zorg (www.pallialine.nl).
- Vraag bij moeilijk behandelbare symptomen en/of complexe problemen advies aan deskundigen (indien nog niet betrokken), bijvoorbeeld een fysiotherapeut, logopedist, ergotherapeut, diëtist en/of gespecialiseerd team palliatieve zorg en/of verwijs naar gespecialiseerde zorgverleners (bijvoorbeeld psycholoog, psychiater, maatschappelijk werker, geestelijk verzorger).
Inleiding
Mensen met gevorderde COPD hebben een hoge prevalentie van lichamelijke en psychische klachten die een negatieve invloed hebben op hun kwaliteit van leven (zie Tabel 1.1) [Fusi-Schmidhauser 2018, Harrington 2017, Janssen 2008, Lilly 2016, Maddocks 2017, Sorathia 2019, Vermylen 2015].
| Symptoom | Laatste jaar | Laatste 1-2 weken |
|---|---|---|
| Vermoeidheid | 68% | 80% |
| Dyspneu | 94% | 90% |
| Slaapproblemen | 65% | 51% |
| Pijn | 68% | 49% |
| Klachten van de mond | 63% | 48% |
| Hoesten | 70% | 52% |
| Gebrek aan eetlust | 51% | 64% |
| Somberheid | 59% | 55% |
| Angst | 53% | |
| Obstipatie | 36% | 25% |
| Verwardheid | 23% | 22% |
| Misselijkheid | 4% |
De kwaliteit van leven van mensen met gevorderde COPD is slechter dan die van mensen met longkanker [Gore 2000, Habraken 2009, Javadzadeh 2016]. Naast de gevolgen van de ziekte zelf speelt comorbiditeit vaak ook een rol. COPD gaat significant vaker gepaard met comorbiditeit dan andere chronische aandoeningen [Yin 2017]. Daarbij gaat het vooral om cerebrovasculaire aandoeningen, andere neurologische aandoeningen, psychiatrische aandoeningen, hypertensie, diabetes mellitus, hartfalen, andere longziekten, darm- en nierziekten, ziekten van het houdings- en bewegingsapparaat en kanker.
Onderbouwing
Onderzoeksvraag
Om de uitgangsvraag van deze module te beantwoorden is een systematische literatuurzoektocht uitgevoerd. De onderzoeksvraag die hiervoor is opgesteld is PICO-gestructureerd en luidt:
Wat is het effect van palliatieve zorg op symptomen en kwaliteit van leven van mensen met COPD?
| Patiënten | Patiënten met COPD |
| Interventie | Palliatieve zorg |
| Comparator | Reguliere zorg |
| Outcome | Kritisch: dyspneu, kwaliteit van leven Belangrijk: vermoeidheid |
De volledige zoekactie, in- en exclusiecriteria en de exclusietabel zijn beschreven in de bijlage 'Zoekverantwoording'.
Literatuurbespreking
De literatuurzoektocht identificeerde vier relevante systematische reviews.
- In de Cochrane review van Gomes et al. [2013] werd gezocht naar vergelijkende studies die het effect van palliatieve zorg thuis evalueerden bij volwassenen met een gevorderde ziekte. Ze includeerden 23 studies (gepubliceerd tot november 2012), waarvan 3 gerandomiseerde studies patiënten met COPD hebben geïncludeerd. Twee studies hiervan [Brumley 2007, Rabow 2004] includeerden een heterogene populatie, maar rapporteerden geen aparte cijfers voor COPD. Aiken et al. [2006] evalueerden het effect van palliatieve zorg thuis bij 130 patiënten met chronisch hartfalen en 62 patiënten met COPD. De resultaten voor COPD werden apart gerapporteerd. Kwaliteit van leven werd gemeten met het SF-36 instrument.
- Mathews et al. [2017] zochten naar studies die het effect van palliatieve en levenseinde interventies evalueerden bij patiënten met gevorderde COPD (gepubliceerd tussen 2015 en 2017). Ze includeerden 19 studies waarvan 3 gerandomiseerde studies. Eén studie [Buckingham 2015] rapporteerde geen kwantitatieve data. Een andere studie [Shany 2017] evalueerde geen palliatieve interventie. Bove et al. [2016] evalueerden het effect van een psycho-educatieve interventie thuis bij 66 patiënten met gevorderde COPD en symptomen van angst. Kwaliteit van leven werd gemeten met het Chronic Respiratory Questionnaire (CRQ) instrument.
- Ora et al. [2019] zochten naar studies, gepubliceerd tussen januari 2008 en december 2018, die het effect bestudeerden van palliatieve interventies onder leiding van een verpleegkundige bij patiënten met COPD. Ze vonden 6 studies, waarvan 4 gerandomiseerde studies. Eén studie [Weber 2017] was echter enkel gepubliceerd als abstract. De studie van Buckingham rapporteerde geen kwantitatieve data [Buckingham 2015]. Een derde studie [Sinclair 2017] includeerde een heterogene populatie, maar rapporteerde geen afzonderlijke cijfers voor COPD. De vierde publicatie betrof het studieprotocol van de studie van Houben et al. [2019]; deze studie onderzocht echter alleen het effect van proactieve zorgplannign (advanced care planning; ACP) bij patiënten met COPD (zie ‘Proactieve zorgplanning’).
- Singer et al. [2016] zochten naar gerandomiseerde studies, gepubliceerd tussen januari 2001 en augustus 2015, die het effect van palliatieve en levenseinde interventies evalueerden bij patiënten met een gevorderde ziekte. Ze includeerden 124 studies, waarvan in 19 studies patiënten met COPD werden geïncludeerd. Hiervan rapporteerden 3 studies aparte resultaten voor patiënten met COPD. De studie van Au et al. [2012] onderzocht het effect van communicatie over het levenseinde en wordt hier verder niet besproken. Egan et al. [2002] evalueerden het effect van casemanagement door verpleegkundigen bij 66 patiënten met COPD. Kwaliteit van leven werd gemeten met de St George Respiratory Questionnaire (SGRQ). Ook de studie van Aiken et al. [2006] werd geïncludeerd.
Aanvullend werden drie gerandomiseerde studies gevonden:
- Duenk et al. [2017a] evalueerden in een cluster-gecontroleerde studie het effect van vroegtijdige palliatieve zorg bij patiënten met COPD. Drie Nederlandse ziekenhuizen met een gespecialiseerd palliatief advies team werden gekozen als interventieziekenhuis (N=90 patiënten), drie ziekenhuizen zonder een dergelijk team fungeerden als controleziekenhuis (N=138 patiënten). De interventie bestond uit proactieve palliatieve zorg met een maandelijkse consultatie gedurende 1 jaar. De primaire uitkomstmaat was kwaliteit van leven, gemeten met de SGRQ.
- Janssens et al. [2019] randomiseerden 49 patiënten met COPD GOLD III of IV tussen vroegtijdige palliatieve thuiszorg gedurende 1 jaar (N=26) of reguliere zorg (N=23). De palliatieve interventie omvatte een maandelijks huisbezoek door een verpleegkundige van ongeveer 1,5 uur, waarbij onder andere werd gefocust op symptomen, voeding en ACP. Alle patiënten werden besproken met een arts palliatieve zorg, die desgewenst door de patiënten kon worden geconsulteerd. De primaire uitkomstmaat was het aantal ziekenhuisopnames, spoedopnames en opnames op de intensive care.
- Scheerens et al. [2019] randomiseerden 39 patiënten met eindstadium COPD (GOLD III of IV) tussen vroegtijdige geïntegreerde palliatieve zorg (N=20) of standaard zorg (N=19). De geïntegreerde palliatieve zorg omvatte een maandelijks huisbezoek gedurende 6 maanden, waarbij aandacht besteed werd aan verschillende zorgaspecten, onder andere ziekte-inzicht, zorgplanning, existentiële / spirituele ondersteuning, enzovoort. Een individueel zorgplan werd opgesteld en telkens aangepast. Kwaliteit van leven werd gemeten met het SF-36 instrument.
Kwaliteit van het bewijs
De review van Gomez et al. [2013] is van zeer goede kwaliteit. Er werd gezocht in meerdere databases zonder restrictie, het volledige reviewproces gebeurde door twee onafhankelijke onderzoekers. De drie andere reviews zijn van behoorlijke kwaliteit [Mathews 2017, Ora 2019, Singer 2016]. In deze reviews werd wel gezocht in een voldoende aantal databases, maar beperkte men zich tot Engelstalige literatuur. Bovendien werden slechts onderdelen van het reviewproces door twee onafhankelijke onderzoekers uitgevoerd.
De drie gerandomiseerde studies hadden een hoog risico op bias. Duenk et al. [2017a] alloceerden de behandeling op basis van de beschikbaarheid van een palliatief advies team (geen randomisatie), waarbij enkel de patiënten geblindeerd waren. Ze hebben geen intention-to-treat analyse uitgevoerd. Janssens et al. [2019] blindeerden noch de patiënten, noch de zorgverleners. Scheerens et al. [2019] blindeerden eveneens niet en hebben ook geen intention-to-treat analyse uitgevoerd.
Effect op dyspneu
Geen enkele van de geïncludeerde studies rapporteerde het effect van palliatieve zorg op dyspneu bij patiënten met COPD.
Effect op vermoeidheid
Geen enkele van de geïncludeerde studies rapporteerde het effect van palliatieve zorg op vermoeidheid bij patiënten met COPD.
Effect op kwaliteit van leven
Zes gerandomiseerde studies rapporteerden het effect van één of andere vorm van palliatieve zorg op kwaliteit van leven bij patiënten met COPD. Er zijn verschillende redenen waarom deze zes studies niet in een meta-analyse kunnen worden gecombineerd. Ten eerste zijn de beschreven interventies te heterogeen (al dan niet thuis en/of vroegtijdig, onder leiding van een verpleegkundige of niet, enzovoort). Bovendien werd kwaliteit van leven gemeten met verschillende instrumenten (SF-36 in drie studies, SGRQ in twee studies, CRQ in één studie). Om die redenen is onderstaande analyse louter beschrijvend.
Twee studies [Aiken 2006, Bove 2016] vonden een positief effect op kwaliteit van leven. Beide studies evalueerden een interventie in de thuissituatie onder leiding van een verpleegkundige. Aiken et al. (case management) vonden een positief effect gemeten met het SF-36 instrument (fysiek functioneren: helling +1,00 vs. -0,95, p < 0,05; algemene gezondheid: helling +0,54 vs. +1,67, p < 0,05), terwijl Bove et al. (psycho-educatieve interventie) een positief effect vonden gemeten met het CRQ-instrument (mastery: gemiddeld verschil na 3 maanden = 0,67; 95%BI 0,18 – 1,17; p=0,016).
Vier studies [Egan 2002, Duenk 2017a, Janssens 2019, Scheerens 2019] toonden geen effect aan op kwaliteit van leven. In twee studies [Janssens 2019, Scheerens 2019] werd een holistische palliatieve interventie in de thuissituatie geëvalueerd. In beide studies werd de interventie ‘vroegtijdig’ genoemd, maar was het niet duidelijk op welke basis. Janssens et al. vonden geen significant effect op kwaliteit van leven gemeten met het SF-36 instrument, maar ze rapporteerden geen cijfers. Scheerens et al. vonden eveneens geen significant effect op kwaliteit van leven gemeten met het SF-36 instrument (week 24; fysiek functioneren: 23,6 vs. 22,9; p=0,12; mentaal functioneren: 35,6 vs. 37,4; p=0,16). De twee andere studies [Egan 2002, Duenk 2017a] evalueerden een palliatieve interventie buiten de thuissituatie die startte tijdens of kort na een ziekenhuisopname vanwege een longaanval. Egan et al. (case management) vonden geen significant effect op kwaliteit van leven gemeten met het SGRQ-instrument na 1 maand (totaal: -1,6 vs. -1,5; p=0,621). Ook Duenk et al. [2017a] (vroegtijdige palliatieve zorg) vonden geen effect op kwaliteit van leven gemeten met het SGRQ-instrument na 3, 6, 9 en 12 maanden (gemiddeld verschil ten opzichte van basis na 12 maanden: -6,71 vs. +3,32; p=0,54).
Over het effect van palliatieve zorg op kwaliteit van leven bij patiënten met COPD leveren de beschikbare gerandomiseerde studies tegenstrijdige informatie. Op basis van de beschikbare gegevens is het niet mogelijk aan te geven welke kenmerken van palliatieve zorg bepalend zijn voor een positief effect. Zo is er bewijs van lage kwaliteit dat case management of een psycho-educatieve interventie in de thuissituatie onder leiding van een verpleegkundige een positief effect heeft. Anderzijds is er bewijs van lage tot zeer lage kwaliteit dat vroegtijdige holistische palliatieve zorg in de thuissituatie geen effect heeft op kwaliteit van leven. Verder is er ook bewijs van lage tot zeer lage kwaliteit dat case management of holistische palliatieve zorg buiten de thuissituatie die start tijdens of kort na een ziekenhuisopname vanwege een longaanval geen effect heeft op kwaliteit van leven.
In alle gevallen betreft het studies met methodologische tekortkomingen en onvoldoende of onduidelijke precisie.
[Aiken 2006, Bove 2016, Duenk 2017a, Egan 2002, Janssens 2019, Scheerens 2019]
Over het effect van palliatieve zorg op dyspneu of vermoeidheid bij patiënten met COPD werden geen gerandomiseerde studies gevonden.
In het Kwaliteitskader palliatieve zorg Nederland wordt palliatieve zorg als volgt gedefinieerd: ‘Palliatieve zorg is zorg die de kwaliteit van leven verbetert van mensen en hun naasten die te maken hebben met een levensbedreigende aandoening of kwetsbaarheid, door het voorkomen en verlichten van lijden, door middel van vroegtijdige signalering en zorgvuldige beoordeling en behandeling van problemen van fysieke, psychische, sociale en spirituele aard. Gedurende het beloop van de ziekte of kwetsbaarheid heeft palliatieve zorg oog voor het behoud van autonomie, toegang tot informatie en keuzemogelijkheden’ [IKNL/Palliactief 2017].
Palliatieve zorg is gericht op:
- behandeling van symptomen
- verbetering dan wel handhaving van kwaliteit van leven en uiteindelijk kwaliteit van sterven
- vaststellen van zorgdoelen en bepalen waarden, wensen en behoeften van de patiënt
- ondersteuning van de naasten, zowel tijdens het ziektetraject als na het overlijden
Zie ook de Algemene principes van palliatieve zorg [PAZORI 2017].
Palliatieve zorg is multidimensioneel en omvat:
- de fysieke dimensie met aandacht voor lichamelijke klachten en problemen
- de psychische dimensie met aandacht voor klachten zoals angst (zie Richtlijn 'Angst' [IKNL 2009140] en depressie (zie Richtlijn 'Depressie' [IKNL 2010]) en voor verwerkings- en aanpassingsvermogen
- de sociale dimensie met aandacht voor interacties met de omgeving en voor de draagkracht en draaglast van de naasten (zie Richtlijn ‘Mantelzorg’ [IKNL 2009])
- de spirituele dimensie met aandacht voor existentiële, ethische en zingevingvraagstukken (zie Richtlijn 'Zingeving en Spiritualiteit' [IKNL 2018])
Deze zorg wordt ook wel totale of integrale zorg genoemd en wordt interdisciplinair geleverd, waarbij de patiënt centraal staat [IKNL/Palliactief 2017]. Interdisciplinair wil zeggen dat de verschillende disciplines een gezamenlijk doel formuleren en een gemeenschappelijke taal hanteren. De disciplines werken samen in plaats van parallel aan elkaar. In figuur 1.1 wordt een schematische weergave gegeven van de interdisciplinaire benadering bij mensen met COPD [Maddocks 2017].
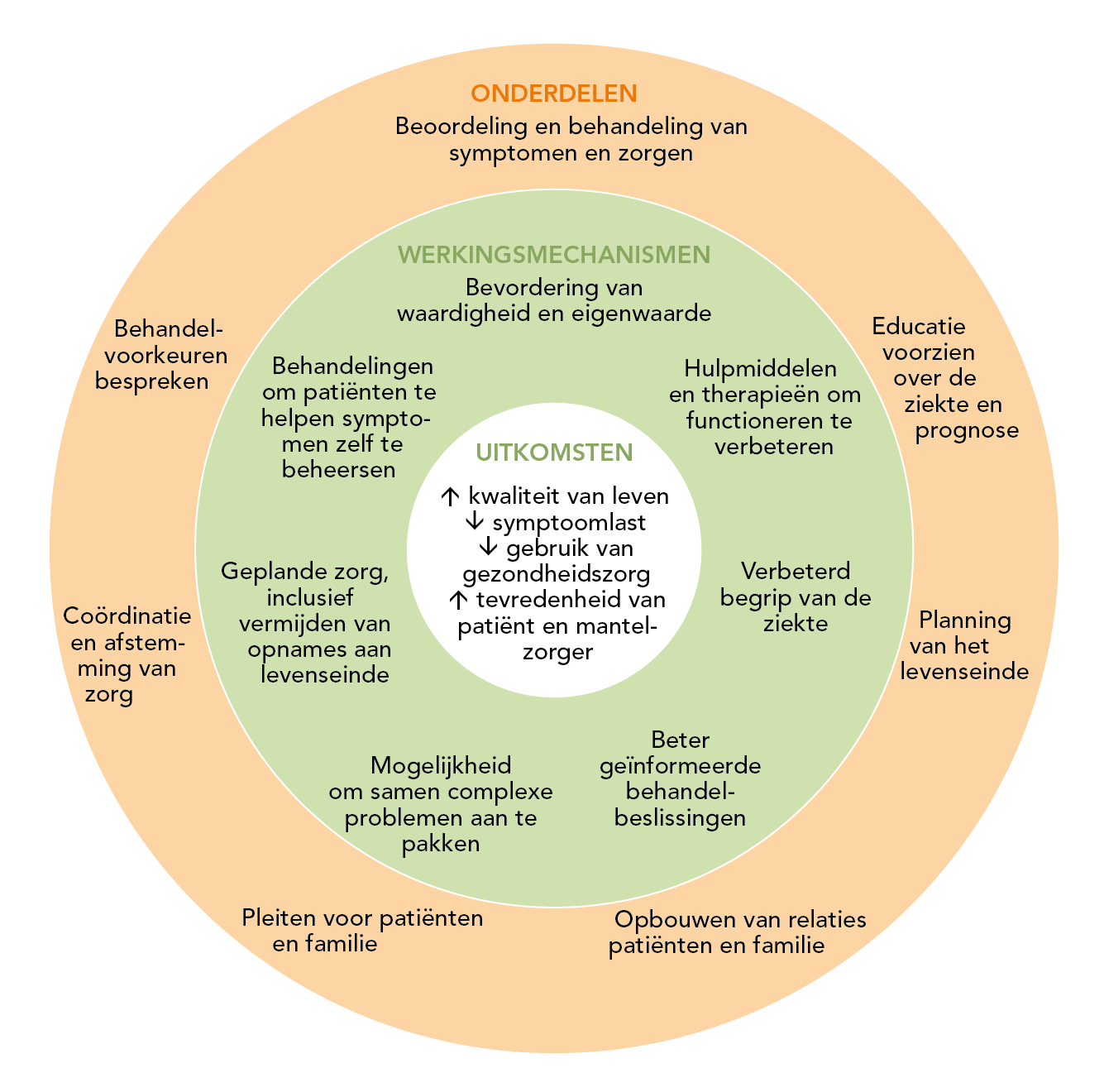
Figuur 1.1. Interdisciplinaire benadering bij palliatieve zorg [Maddocks 2017]. Reprinted with permission from Lancet
In Nederland wordt palliatieve zorg in de meeste gevallen verleend door generalisten. Bij mensen met COPD betreft het vooral huisartsen, specialisten ouderengeneeskunde, longartsen, klinisch geriaters, verpleegkundig specialisten, (long)verpleegkundigen en verzorgenden (zie ‘Organisatie van zorg’).
In een enquête onder 256 longartsen (in opleiding) in Nederland gaf 55% aan de palliatieve zorg voor opgenomen mensen met COPD voor zijn/haar eigen rekening te willen nemen [Duenk 2017b]. In de poliklinische setting gaf 71% de voorkeur aan een gezamenlijke en multidisciplinaire benadering door longarts, huisarts en longverpleegkundige of verpleegkundig specialist of physician assistant.
Hoewel het literatuuronderzoek geen eenduidige conclusies oplevert over het effect van palliatieve zorg op kwaliteit van leven en symptomen bij mensen met COPD, is de werkgroep van mening dat palliatieve zorg tijdig moet worden ingezet bij mensen met gevorderde COPD.
De werkgroep is van mening dat het belangrijk is om regelmatig (ten minste jaarlijks en zo nodig vaker, als de situatie daar aanleiding toe geeft) een gesprek te voeren om (het begrip van) de situatie, de (gezondheids)vaardigheden en de wensen van de patiënt en diens naasten te evalueren. Daarbij wordt ingegaan op de symptomen, de betekenis daarvan voor het fysiek, psychisch, sociaal en spiritueel functioneren en de ziektelast. Bij het bepalen van symptomen kan zo nodig gebruik gemaakt worden van meetinstrumenten (bijvoorbeeld het Utrecht Symptoom Dagboek (USD) of de Lastmeter). Bij het bepalen van de ziektelast kan zo nodig gebruik gemaakt worden van meetinstrumenten (bijvoorbeeld de Ziektelastmeter COPD, de COPD Control Questionnaire (CCQ) of de COPD Assessment Test (CAT)). Daarnaast kunnen gedachtes en wensen van de patiënt ten aanzien van de toekomst en behandeldoelen geëxploreerd worden en kan, indien mogelijk en gewenst, de prognose besproken worden.
De zorgverlener is in staat om bij klachten of problemen te onderkennen of alledaagse aandacht voldoet en wanneer er behoefte bestaat aan begeleiding, behandeling of een crisisinterventie [IKNL/Palliactief 2017].
De naasten en mantelzorgers spelen een sleutelrol in het bieden van ondersteuning en zorg aan de patiënt. Een goede samenwerking tussen zorgverleners en mantelzorgers is essentieel. De zorgverlener besteedt apart aandacht aan (gezondheids)vaardigheden, draagkracht, draaglast, waarden, wensen en behoeften van de naasten, zowel tijdens het ziekteproces als na het overlijden (zie ook ‘Problemen op psychosociaal en existentieel gebied’).
Bij COPD is er – anders dan meestal bij de ziekte kanker – geen scherpe scheiding te maken in de overgang naar de palliatieve fase. COPD is een ongeneeslijke en potentieel levensbedreigende ziekte. Het is onzeker of en vooral wanneer de patiënt aan de ziekte zal overlijden. Gedurende vrijwel het hele ziektetraject worden de symptomen (vooral dyspneu, vermoeidheid en in mindere mate hoesten) het beste verlicht door middel van ziektegerichte behandeling met medicatie (meestal bronchusverwijders en (vooral bij longaanvallen) eventueel corticosteroïden), zuurstoftherapie indien geïndiceerd, niet-invasieve beademing indien geïndiceerd en longrevalidatie. Bij een progressief beloop van de ziekte wordt het steeds moeilijker om de symptomen te controleren. Niet-medicamenteuze behandelingen (bijvoorbeeld ademhalingssoefeningen, rollator, ventilator) en opioïden kunnen worden ingezet voor betere controle van de dyspneu. Daarnaast kan er sprake zijn van toenemende psychische symptomen zoals somberheid en angst, waarvoor psychologische ondersteuning en soms antidepressiva en/of anxiolytica worden ingezet. Het geheel van deze maatregelen wordt wel symptoomgerichte palliatie genoemd (zie Algemene principes van palliatieve zorg [PAZORI 2017]).
Vanuit het perspectief van de huisarts betreft het de patiëntengroep met palliatieve zorgbehoeften, waarbij ziektegerichte behandeling niet meer of niet meer voldoende verlichting geeft. Meestal gaat het om patiënten met een lang bestaande verhoogde of ernstige ziektelast. Een deel van deze patiënten is terugverwezen vanuit de tweede lijn, omdat specialistische behandeling geen voordelen meer biedt. Het gaat om de populatie die aangeduid wordt in paragraaf 'Beleid in eindstadium COPD’ van de NHG Standaard COPD [NHG 2021].
Als er sprake is van moeilijk behandelbare symptomen en/of complexe problematiek kunnen de andere richtlijnen palliatieve zorg worden geraadpleegd (www.pallialine.nl). Deze richtlijnen hebben betrekking op lichamelijke en psychische symptomen, zorg in de stervensfase, zorg op psychosociaal en spiritueel gebied (mantelzorg, spirituele zorg, rouw) en beslissingen rond het levenseinde (palliatieve sedatie, euthanasie).
Bij moeilijk behandelbare symptomen en/of complexe problemen kan advies gevraagd worden aan deskundigen (indien nog niet betrokken), bijvoorbeeld een fysiotherapeut, logopedist, ergotherapeut, diëtist en/of gespecialiseerd team palliatieve zorg. Ook kan worden verwezen naar gespecialiseerde zorgverleners (bijvoorbeeld een psycholoog, psychiater, maatschappelijk werker, geestelijk verzorger).
In de stervensfase verschuift de focus van kwaliteit van leven naar kwaliteit van sterven (zie Richtlijn ‘Zorg in de stervensfase’ [IKNL 2010]). De ziektegerichte behandeling wordt meestal tot kort voor het overlijden voortgezet. De mate van ziektegerichte behandeling neemt af naarmate het overlijden nadert en de palliatieve zorg neemt toe (zie figuur 1.2). Ten slotte omvat palliatieve zorg ook de zorg voor de nabestaanden na het overlijden.
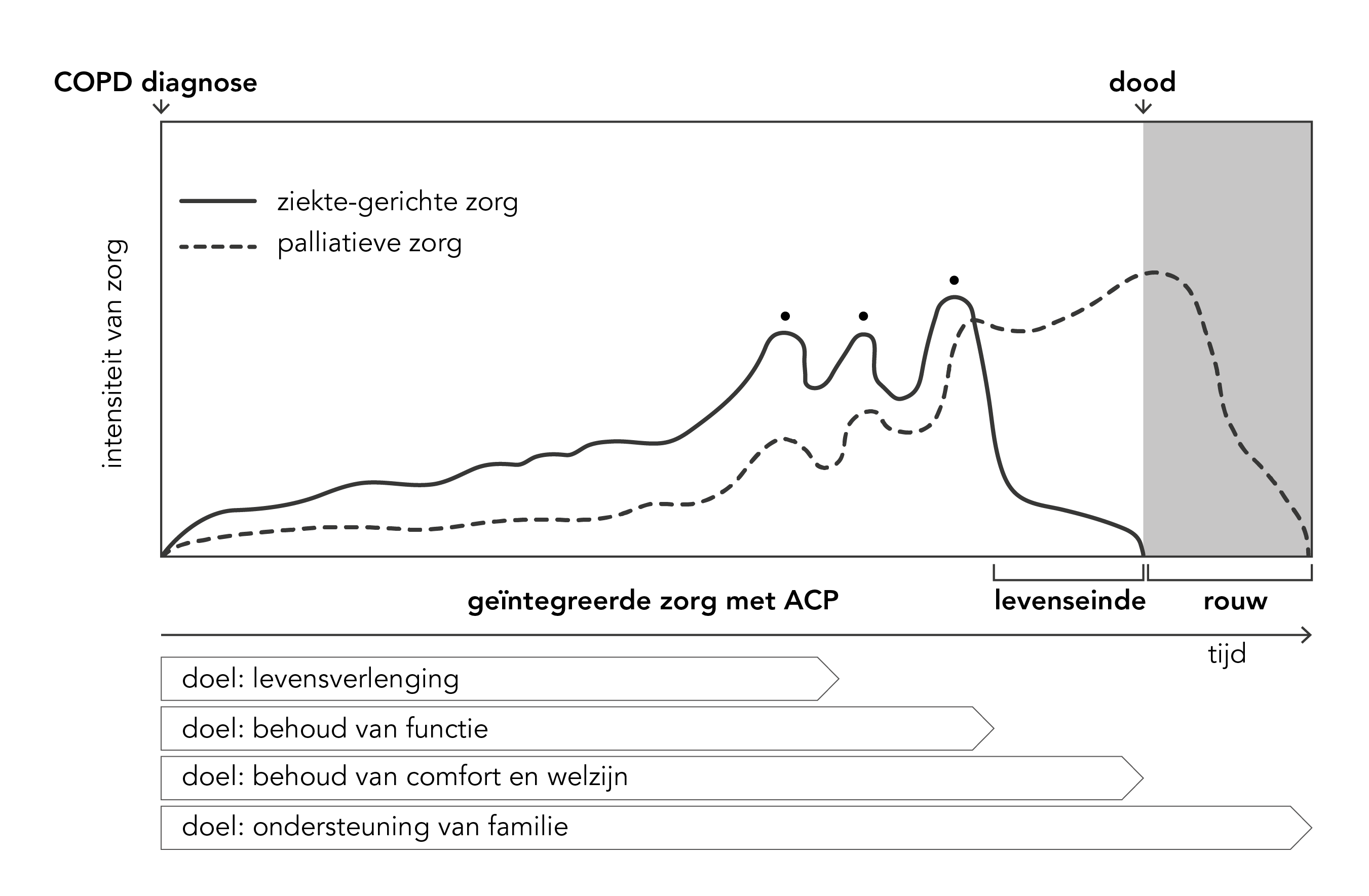 Figuur 1.2. Ziektegerichte behandeling en palliatieve zorg bij COPD [Harrington 2017]
Figuur 1.2. Ziektegerichte behandeling en palliatieve zorg bij COPD [Harrington 2017]
Er is toenemende aandacht voor palliatieve zorg bij mensen met COPD [Fusi-Schmidhauser 2018, Hardin 2008, Harrington 2017, Lal 2014, Landers 2017, Lilly 2016, Maddocks 2017, Murray 2006, Seamark 2007, Sorathia 2019, Vermylen 2017]. Dit heeft geleid tot een verandering van focus bij mensen met gevorderde COPD met meer en vroeger in het ziektebeloop aandacht voor longrevalidatie, kwaliteit van leven, symptoombestrijding, communicatie en ACP.
Het ziektebeloop (en daarmee ook de prognose) is bij COPD moeilijk te voorspellen [Harrington 2017, Landers 2017, Lilly 2016, Sorathia 2019]. Mensen met COPD overlijden in 50-70% aan andere oorzaken zoals comorbiditeit [Gedebjerg 2018].
Zowel onderzoek als praktijk laten zien dat palliatieve zorg vaak (te) laat wordt ingezet bij mensen met COPD [Butler 2020, Gore 2000, Hardin 2008 Halpin 2018, Harris 2007]. Palliatieve zorg wordt later ingezet bij mensen met COPD dan bij mensen met longkanker, terwijl ze zeker niet minder klachten en problemen hebben [Gore 2000, Hardin 2008].
In een systematische literatuurstudie van Butler et al. [2020] zijn 19 publicaties geanalyseerd van onderzoek naar palliatieve zorg services, medicatie, levensverlengende interventies, plaats van overlijden, symptoomlast, gezondheidsgerelateerde kwaliteit van leven van mensen met COPD en longkanker. Uit de resultaten bleek dat zowel mensen met COPD als mensen met longkanker lage gezondheidsgerelateerde kwaliteit van leven in de laatste levensfase hebben en een vergelijkbare symptoomlast ervaren. Mensen met COPD ontvangen echter minder palliatieve zorg en slechtere symptoommanagement, maar meer levensverlengende interventies in de laatste levensfase dan mensen met longkanker.
Verklaringen voor het niet of te laat inzetten van palliatieve zorg bij mensen met COPD zijn [Epiphaniou 2014, Hardin 2008, Harrington 2017, Mason 2016, Vermylen 2015]:
- Gevorderde COPD wordt zowel door patiënten als door zorgverleners niet altijd als een levensbedreigende aandoening gezien.
- Misvattingen over palliatieve zorg. Palliatieve zorg wordt beschouwd als synoniem voor terminale zorg en het inzetten van palliatieve zorg wordt door patiënten, naasten en soms ook door zorgverleners gezien als een doodvonnis op korte termijn.
- Barrières van zowel patiënten als zorgverleners om het gesprek over het levenseinde aan te gaan.
- Het moeilijk kunnen voorspellen van het ziekteverloop en de levensverwachting (zie ‘Prognostische factoren bij COPD en markering van de palliatieve fase’ in deze module).
Andere factoren die bijdragen aan het (te) laat inzetten van palliatieve zorg zijn [Stuurgroep Passende zorg in de laatste levensfase 2015]:
- ‘niet opgeven’ als basishouding
- doen is beter dan laten; opleidingen en richtlijnen zijn gericht op doen
- ziekte- i.p.v. mensgerichte benadering
- te veel zorgverleners en onvoldoende afstemming van de zorg
De vraag wanneer er sprake is van palliatieve zorg bij mensen met COPD roept veel discussie op. In de eerdergenoemde survey bij 256 longartsen (in opleiding) in Nederland gaf 92% aan dat markering van de palliatieve fase en tijdig inzetten van palliatieve zorg van groot belang is [Duenk 2017b]. Frequente ziekenhuisopnames, het oordeel van de longarts, de wens van de patiënt en ernstige comorbiditeit werden door meer dan 75% als criteria genoemd.
De werkgroep is er geen voorstander van om de palliatieve fase bij de diagnose te laten beginnen. COPD is immers niet altijd een progressieve ziekte. De stadiëring volgens GOLD lijkt evenmin geschikt voor markering van de palliatieve fase.
Bij het markeren van de palliatieve fase bij mensen met COPD wordt vaak gebruik gemaakt van factoren en indices, die onderzocht zijn op hun prognostische betekenis (voorspelling van overlijden op korte termijn), maar niet op hun predictieve waarde (voorspelling van noodzaak en effectiviteit van het inzetten van palliatieve zorg).
In onderstaande tekst wordt ingegaan op achtereenvolgens prognostische factoren bij COPD, de waarde van de ‘surprise question’ en ‘mijlpalen’ in het leven van mensen met COPD als aanleiding voor het inzetten van palliatieve zorg.
Prognostische factoren bij COPD en markering van de palliatieve fase
De richtlijn ‘Palliatieve zorg voor mensen met COPD’ van LAN [2011] gaf aan de hand van referenties van O’Kelly [2007], Curtis [2008] en Murray [2006] aan dat de markering van de palliatieve fase wordt bepaald door (de verslechtering in) het klinische beeld, het ondergaan hebben van intensieve behandelingen zonder (blijvend) effect, de subjectieve inschatting en wensen van de patiënt en de inschatting van zorgverleners. Als hulpmiddelen werden genoemd FEV1 <30% van voorspeld, slechte bloedgassen, cor pulmonale (met pulmonale hypertensie), MRC-dyspneu schaal score van 5, BMI <21 kg/m2 of spiermassaverlies, slechte kwaliteit van leven-score (CCQ of SGRQ), relevante comorbiditeit (bijvoorbeeld hartfalen) en frequente ziekenhuisopnames vanwege een acute longaanval, steeds kortere intervallen tussen deze opnames en beperkte vooruitgang na opnames.
Een aantal recentere studies en reviews onderzochten welke factoren voorspellend zijn voor een overlijden en daarmee aanleiding zouden (kunnen) zijn voor het inzetten van palliatieve zorg [Almagro 2017 en 2019, Batzlaff 2014, Bloom 2019, Carone 2016, Singanayagam 2013, Smith 2017, Steer 2010]. Steer [2010] verrichtte een review naar welke factoren voorspellend waren voor overlijden (tijdens ziekenhuisopname of daarna) bij mensen met COPD, die waren opgenomen in het ziekenhuis vanwege een longaanval. Daarbij kwamen de volgende factoren consistent naar voren als voorspellers van overlijden na ontslag: oudere leeftijd, slechte voedingstoestand, comorbiditeit (cardiaal, diabetes mellitus, cor pulmonale), functionele beperkingen, slechte kwaliteit van leven, eerdere ziekenhuisopnames vanwege longaanvallen, onderhoudsbehandeling met corticosteroïden, hypercapnie, verhoogd troponine en lage FEV1.
Singanayagam [2013] verrichtte een systematische review van 37 studies bij in totaal 189.772 mensen met COPD, die vanwege een longaanval waren opgenomen in het ziekenhuis. Oudere leeftijd, mannelijk geslacht, lage BMI, comorbiditeit (cor pulmonale, hartfalen, nierfalen), verwardheid, langdurig gebruik van zuurstof, respiratoire acidose, oedeem aan de benen, GOLD stadium 4 en verhoogd troponine waren geassocieerd met overlijden op korte termijn.
Batzlaff [2014] onderzocht 591 mensen met COPD, die waren opgenomen vanwege een longaanval op een intensive care. Bij multivariate analyse waren leeftijd en duur van de opname op de intensive care onafhankelijke voorspellers van overleving na 1 jaar.
Carone [2016] onderzocht voorspellers van overleving bij 221 mensen met COPD, die behandeld werden met langdurige toediening van zuurstof of niet-invasieve beademing thuis. In de univariate analyse waren hogere leeftijd, lage vitale capaciteit, zuurstofgebruik in rust, slechte kwaliteit van leven en verminderde fysieke activiteit voorspellend voor overlijden. In de multivariate analyse waren alleen hogere leeftijd, zuurstofgebruik in rust en slechtere gezondheidsstatus (gemeten m.b.v. vragenlijsten) voorspellend voor overlijden.
In de review van Smith [2017] was geen enkele individuele variabele voorspellend voor een overlijden binnen 1 jaar. Er waren een aantal multivariabele indices (ADO, B-AE-D, BODE(x), e/mBODE, DOSE, SAFE) die wel voorspellend waren. Leeftijd >70 jaar, roken, FEV1 <30% van voorspeld, lage BMI, loopafstand, dyspneuscore, slechte kwaliteit van leven, eerdere ziekenhuisopname(s) vanwege een longaanval en comorbiditeit waren onderdeel van deze indices.
In de studie van Almagro [2017] werden een aantal variabelen (gekozen op basis van een systematische review) getest in een cohort van 797 mensen met COPD, die waren opgenomen vanwege een longaanval. Zeven variabelen waren voorspellend voor een overlijden binnen 1 jaar met een hazard ratio variërend van 1.6 tot 2.6:
- leeftijd >70 jaar
- slechte kwaliteit van leven (SGRQ-score >60)
- BMI <21 kg/m2
- serumalbumine <35 g/l
- depressie (Geriatric Depression Scale (GDS) >5)
- chronisch gebruik van zuurstof
- dyspneu (MRC-score >3)
Twee multivariabele indices (BODE en CODEX) waren het best voorspellend voor overlijden binnen 1 jaar (hazard ratio’s van resp. 3.74 en 2.42). BMI, FEV1 <30% van voorspeld, dyspneuscore, verminderde loopafstand, eerdere ziekenhuisopname(s) vanwege een longaanval en comorbiditeit waren onderdeel van deze indices. De sensitiviteit en specificiteit bedroegen 0.47 en 0.82 respectievelijk voor de BODE (afkappunt >7) en 0.49 en 0.73 respectievelijk voor de CODEX (afkappunt >7). Geen van de variabelen of indices had een area under the curve (AUC) >0.7 (NB een AUC van 0,7-0,8 is acceptabel; een AUC van >0,8 is uitstekend).
De studies van Amagro [2017] en Smith [2017] constateerden dat geen van de onderzochte variabelen en indices in staat waren om het overlijden van mensen met COPD goed te voorspellen [Almagro 2017, Smith 2017].
Guerra [2018] vergeleek 10 verschillende prognostische indices binnen 24 cohortstudies bij in totaal 15.762 mensen met COPD voor overlijden binnen 3 jaar. De mediane AUCs voor de verschillende indices varieerden van 0.613 (klassieke GOLD stadiëring, gebaseerd op FEV1) tot 0.679 (ADO, gebaseerd op leeftijd, dyspneuscore en FEV1).
In een tweede studie van Almagro [2019] werd de voorspellende waarde van de CODEX voor overlijden na 3 maanden, 1 en 10 jaar getest bij 3321 mensen met COPD. In de CODEX zijn opgenomen: comorbiditeit, FEV1, dyspneu en ziekenhuisopname vanwege COPD. De AUC bedroeg 0.72 voor overlijden binnen 3 maanden, 0.70 voor overlijden binnen 1 jaar en 0.76 voor overlijden binnen 10 jaar.
Bloom [2019] onderzocht de voorspellende waarde van de BARC-index voor overlijden binnen 1 jaar. Aan de hand van een cohort van 27.472 mensen met COPD (training set) werd de BARC-index ontwikkeld. In de BARC zijn 18 risicofactoren opgenomen: hoge leeftijd, mannelijk geslacht, roken, diverse comorbiditeiten (astma, atriumfibrilleren, CVA, dementie, nierinsufficiëntie, longkanker, longfibrose), lage BMI, hoge dyspneuscore, lage FEV1, ziekenhuisopnames vanwege longaanvallen en uitslagen laboratoriumonderzoek (laag Hb, hoge trombocyten, hoog serumcreatinine, laag serumalbumine). De index werd vervolgens getest in een testset van 27.518 patiënten en een externe set van 4931 mensen met COPD. De C-index van de BARC-index was 0.79 in de testset en 0.67 in de externe set (een C-index van 0,5-0,7 impliceert een zwak model, een C-index van 0,7-0,8 een goed model en een C-index >0,8 een uitstekend model). De AUCs bedroegen 0.781 in de testset en 0.695 in de externe set en waren hoger dan de AUCs van andere prognostische indices (ADO: 0.675 resp. 0.568); BODEX (0.483 en 0.413): DOSE (0.591 en 0.515)). De BARC was een nauwkeurige voorspeller van overlijden binnen 1 jaar (testset: voorspeld 30% versus 31% geobserveerd; externe set 27% versus 22%).
Recent is de ProPal-COPD tool ontwikkeld om mensen met COPD te identificeren die in aanmerking komen voor palliatieve zorg aan de hand van factoren die voorspellend waren voor overlijden binnen 1 jaar [Duenk 2017c]. Na onderzoek bij 155 mensen met COPD, die vanwege een longaanval waren opgenomen in het ziekenhuis, zijn in het uiteindelijke model als variabelen opgenomen: CCQ Score >3, MRC dyspneu-score 5, FEV1 <30% van voorspeld, eerdere ziekenhuisopname vanwege een longaanval, BMI <21 kg/m2, ernstige comorbiditeit (inclusief cor pulmonale) en antwoord ‘nee’ op de ‘surprise question’ (zie ‘surprise question’ in deze module). Bij de gekozen cut-off bedroeg de sensitiviteit 0.90, de specificiteit 0.73 en de AUC 0.82. De ProPal-COPD was een betere voorspeller voor overlijden binnen 1 jaar dan de eerdergenoemde CODEX-index. Dit model zal in grotere groepen moeten worden getest.
In het afgelopen decennium zijn er ook diverse generieke instrumenten ontwikkeld om zorgverleners te helpen patiënten te identificeren die een verhoogde kans op achteruitgang of overlijden hebben en die dus baat zouden kunnen hebben bij het tijdig inzetten van palliatieve zorg [Maas 2013, Walsh 2015]. Ook hierbij is gebruik gemaakt van prognostische factoren.
Een van de eerste instrumenten was de RADPAC (RADboud indicators for PAlliative Care needs) [Thoonsen 2012, Smith 2017]. Deze is ontwikkeld voor huisartsen en bevat zes identificatiecriteria bij COPD, die elk zouden kunnen triggeren om palliatieve zorg in te zetten:
- De patiënt heeft veel hulp nodig en frequente medische verzorging (Karnofsky performance status < 50).
- De patiënt heeft fors gewichtsverlies (>10% binnen 6 maanden).
- Er is hartfalen aanwezig.
- De patiënt heeft orthopnoe.
- De patiënt geeft signalen het naderende einde in te zien.
- Er zijn objectieve tekenen van ernstige dyspneu aanwezig (beperkt inspanningsvermogen, dyspnoïsch bij spreken, gebruik van hulpademhalingsspieren en orthopnoe).
Rond dezelfde tijd werd in Edinburgh de SPICT (Supportive and Palliative Care Indicators Tool) ontwikkeld, welke jaarlijks geüpdatet wordt met commentaar vanuit zorgverleners [Highet 2014, Smith 2017] en ook jaarlijks in het Nederlands vertaald wordt (SPICT-NL). De SPICT overlapt gedeeltelijk met de RADPAC, maar is voor alle bij palliatieve zorg betrokken zorgverleners in de eerste en tweede lijn ontwikkeld. De SPICT bevat een aantal generieke identificatiecriteria en daarnaast per ziektegroep nog één of meerdere specifieke criteria. De generieke criteria, zoals geformuleerd in versie 2019, zijn:
- ongeplande ziekenhuisopnames
- functionele status is laag of gaat achteruit, met beperkt herstelvermogen (overdag 50% of meer in bed of op stoel)
- afhankelijk van anderen voor zorgbehoeften, door fysieke en/of mentale problemen
- de mantelzorger heeft meer hulp en ondersteuning nodig
- progressief gewichtsverlies, blijvend ondergewicht, lage spiermassa
- persisterende symptomen ondanks optimale behandeling van onderliggende aandoening(en)
- de patiënt (of diens naaste) vraagt om palliatieve zorg, kiest om verdere behandeling te verminderen, te staken of ervan af te zien of wenst een focus op kwaliteit van leven
De ziektespecifieke criteria van de SPICT voor respiratoire aandoeningen betreffen: ernstige, chronische ziekte met in de periode tussen longaanvallen dyspneu in rust of bij geringe inspanning, persisterende hypoxie waardoor chronische afhankelijkheid van zuurstof en/of eerdere beademing in verband met respiratoir falen of contra-indicatie voor beademing.
Verder is de Gold Standards Framework Proactive Identification Guidance (GSF-PIG) [Smith 2017] ontwikkeld om de zorg in de laatste levensfase te optimaliseren. De GSF-PIG gaat uit van een negatief antwoord op de ‘surprise question’ en geeft (naast een aantal algemene criteria) aan dat voor COPD ten minste voldaan moet zijn aan twee van de volgende criteria:
- ten minste drie ziekenhuisopnames in het afgelopen jaar vanwege longaanval
- ernstige dyspneu (MRC graad 4: dyspneu na 100 meter lopen)
- FEV1 <30% van voorspeld en/of persisterende symptomen ondanks optimale behandeling
- voldoet aan criteria voor chronische behandeling met zuurstof (PaO2 <55 mmg Hg (7,3 kPa))
- noodzaak voor (non-)invasieve beademing tijdens ziekenhuisopname
- andere factoren bijvoorbeeld cor pulmonale, anorexie/cachexie, >6 weken gebruik van corticosteroïden in de afgelopen 6 maanden, palliatieve medicatie voor dyspneu of (ex-)roker
De ‘surprise question’
Zowel de richtlijn van LAN [2011] als het Kwaliteitskader palliatieve zorg Nederland [IKNL/Palliactief 2017] bevelen aan om bij het markeren van de palliatieve fase de zogenaamde ‘surprise question’ te gebruiken: ‘Zou het mij verbazen wanneer deze patiënt in de komende 12 maanden komt te overlijden?’ [IKNL/Palliactief 2017]. Als het antwoord op deze vraag ‘nee’ is, kan dit gebruikt worden om de palliatieve fase te markeren en daarover met de patiënt in gesprek te gaan en palliatieve zorg vroegtijdig in te zetten.
De voorspellende waarde van de ‘surprise question’ ten aanzien van de sterfte binnen 1 jaar is niet goed onderzocht bij mensen met COPD. In een meta-analyse was de sensitiviteit bij mensen met een niet-maligne aandoening 60,7%, de specificiteit 75,9%, de voorspellende waarde van het antwoord ‘nee’ 31,3% en de voorspellende waarde van het antwoord ‘ja’ 93,2% [Downar 2017].
Een onderzoek bij 93 mensen met COPD, die in het ziekenhuis waren opgenomen vanwege een longaanval, onderzocht de relatie tussen het antwoord op de ‘surprise question’ en de behoefte aan palliatieve zorg, zoals gemeten met de criteria van de Gold Standards Framework (GSF) [Noppe 2019]. Er was een significant verschil in het aantal criteria waaraan voldaan werd (gemiddeld 4 bij het antwoord ‘nee’ en 1 bij het antwoord ‘ja’, p<0,001). Bij het antwoord ‘ja’ werden echter 74,1% van de patiënten gemist die minimaal aan 1 criterium van de GSF voldeden en 48,3% van de patiënten die minimaal aan 2 criteria van de GSF voldeden. In een andere studie bij 199 patiënten, opgenomen vanwege een longaanval, werden meer prognostisch ongunstige factoren gezien bij mensen waarbij het antwoord op de ‘surprise question’ ‘nee’ was [South 2011].
Het gebruik van de ‘surprise question’ bij mensen met COPD roept discussie op [Janssen 2015, Small 2010]. Tegenstanders van deze benadering voeren aan dat er geen betrouwbare criteria zijn om het overlijden op korte termijn van mensen met COPD te voorspellen en dat dit kan leiden tot de zogenaamde ‘prognostic paralysis’: palliatieve zorg wordt niet of (veel) te laat ingezet omdat het moment van overlijden niet goed voorspelbaar is [Cawley 2014, Epiphaniou 2014, Giacomini 2012, Kendall 2014, Murray 2006, Pinnock 2011]. Zij pleiten er voor om meer vanuit de beleving en het perspectief van de patiënt te denken [Disler 2014, Giacomini 2012, Pinnock 2011]. Andere tegenstanders (in Engeland) beargumenteren dat de palliatieve zorgbenadering ook relevant is voor mensen met een langere levensverwachting en zijn bang dat het ten koste zal gaan van de zorg door de behandelaar zelf [Small 2010]. Dit is voor de Nederlandse situatie niet erg relevant, omdat veel palliatieve teams niet zelf patiënten behandelen, maar alleen advies geven. De belangrijkste functie van de ‘surprise question’ zou kunnen zijn om bewustzijn bij de zorgverleners te creëren dat bepaalde mensen een risico hebben om binnen 12 maanden te overlijden, om de zorg, benadering en communicatie met de patiënt en diens naasten daarop aan te passen en om palliatieve zorg in te zetten en niet primair om de levensverwachting te voorspellen [Murray 2011, Janssen 2015, Noppe 2019]. De werkgroep deelt deze mening.
‘Mijlpalen’ als markering van de palliatieve fase
Verschillende auteurs pleiten ervoor (aan de hand van interviews met mensen met COPD) om de palliatieve fase bij mensen met COPD te markeren aan de hand van ‘mijlpalen’: herkenbare momenten of gebeurtenissen in hun leven die aanleiding zijn om palliatieve zorg in te zetten [Cawley 2014, Landers 2015, Reinke 2008].
Daarbij worden als mijlpalen genoemd:
- ernstige beperkingen in fysieke activiteiten
- noodzaak voor ondersteuning bij zelfzorg
- angstaanvallen
- aanpassingen in het huis of noodzaak om te verhuizen, bijvoorbeeld naar gelijkvloerse woning of verpleeghuis
- overbelasting van de mantelzorg
- start van onderhoudsbehandeling met zuurstof
- ziekenhuisopnames vanwege longaanvallen
De werkgroep is van mening dat de volgende ‘mijlpalen’ ook relevant zijn:
- arbeidsongeschiktheidsverklaring
- afwijzing voor longtransplantatie of bronchoscopische of chirurgische interventies ter vermindering van hyperinflatie
- start van niet-invasieve beademing thuis
Samengevat is er niet een hard criterium voor het markeren van de palliatieve fase bij COPD. Er is geen onderzoek gedaan naar predictieve factoren (dat wil zeggen factoren die aangeven dat inzetten van palliatieve zorg noodzakelijk en effectief is). In de praktijk wordt gebruik gemaakt van prognostische factoren (dat wil zeggen factoren die voorspellen voor een korte overleving). Er is echter niet één duidelijke voorspellende factor voor de overleving en de onderzochte indices zijn onvoldoende voorspellend en/of in de dagelijkse praktijk niet bruikbaar. Er kan ook gebruik gemaakt worden van ‘mijlpalen’: momenten of gebeurtenissen in het leven van de patiënt, die aangeven dat er mogelijk behoefte is aan palliatieve zorg.
De werkgroep is daarom van mening dat palliatieve zorg ingezet moet worden indien er sprake is van twee of meer van de volgende factoren:
- het antwoord ‘nee’ op de ‘surprise question’: ‘Zou het mij verbazen wanneer deze patiënt in de komende 12 maanden komt te overlijden?’
- klachten en/of problemen op lichamelijk, psychisch, sociaal en/of spiritueel gebied die ondanks optimale ziektegerichte behandeling onacceptabel zijn voor de patiënt en leiden tot afname van kwaliteit van leven
- slechte lichamelijke toestand (ernstige beperking in activiteiten, ADL-afhankelijkheid, Karnofsky performance status ≤ 50%)
- ondergewicht, vastgesteld door middel van de volgende factoren:
- lage BMI (<21 kg/m2)
- ongewenst gewichtsverlies van >5% in de laatste 6 maanden of >10% over een langere periode (>6 maanden) en/of
- lage vetvrije massa-index (VVMI, mannen <17 kg/m2, vrouwen <15 kg/m2)
- ernstige dyspneu (MRC-score 5: te dyspnoïsch om uit huis te gaan of dyspneu tijdens aan- en uitkleden)
- FEV1 <30% van voorspeld
- start chronisch gebruik van zuurstof of thuisbeademing
- één of meer ziekenhuisopnames vanwege een longaanval per jaar
- ernstige comorbiditeit (bijvoorbeeld cor pulmonale, hartfalen, nierinsufficiëntie, diabetes mellitus, kanker)
- ‘mijlpalen’ zoals:
- arbeidsongeschiktheidsverklaring
- opname met (niet-invasieve) beademing
- afwijzing voor longtransplantatie of bronchoscopische of chirurgische interventies ter vermindering van hyperinflatie
- overbelaste mantelzorger
- noodzaak tot verhuizing of aanpassing van de woning
