Symptomatische medicamenteuze behandeling
Uitgangsvraag
Bij patiënten met dyspneu in de palliatieve fase: is er een effect van medicatie op dyspneu, kwaliteit van leven, fysiek functioneren en/of inspanningstolerantie ten opzichte van placebo, geen behandeling of andere (medicamenteuze of niet-medicamenteuze) behandeling?
Methode: evidence based
Aanbevelingen
Ter verlichting van dyspneu bij patiënten in de palliatieve fase:
- Zet sterk werkende opioïden in:
| Indien orale medicatie mogelijk en gewenst is | Indien een snel effect gewenst is en/of de orale weg niet mogelijk of gewenst is | |
|---|---|---|
| Bij opïoidnaïeve patiënt |
Slow release morfine 2dd 10 mg p.o. Alternatief: immediate release morfine z.n. of 6dd 2,5-5 mg p.o. Switch naar slow release morfine als de effectieve dagdosis is gevonden. Geef 2dd de helft van de effectieve dagdosis. |
Geef z.n. 2,5 mg (bij ernstige dyspneu doseringen tot 20 mg) of 6dd 2,5 mg morfine s.c. of i.v. Alternatief: 15 mg/24 uur continu s.c. of i.v. |
| Indien patiënt reeds morfine gebruikt in verband met pijn | Hoog de dosis met 25-50% op. |
Hoog de dosering op met 25-50% en bepaal de equi-analgetische dagdosis morfine s.c./i.v. Geef bij intermitterende injecties z.n. of 6dd 1/6 van de dagdosis. Geef bij continue infusie de dagdosis in 24 uur. |
| Indien patiënt reeds een ander opioïd gebruikt in verband met pijn: |
Roteer naar morfine en geef daarbij de equi-analgetische dosis p.o. Alternatief: Hoog dosering van het opioïd op met 25-50%. |
Bepaal de equi-analgetische dagdosis morfine s.c./i.v. Geef bij intermitterende injecties z.n. of 6dd 1/6 van de dagdosis. Geef bij continue infusie de dagdosis in 24 uur. |
| Beoordeling effect | Na 24 uur. Hoog bij onvoldoende effect op in stappen van 25-50%. | Na 4 uur. Hoog bij onvoldoende effect op in stappen van 25-50%. |
| Dosering rescue medicatie | In alle gevallen: z.n. 1/6 van de dagdosis. | |
- Gebruik rescue medicatie alleen voor aanvalsgewijze dyspneu, die naar verwachting langer dan 30 minuten zal aanhouden.
- Gebruik voor conversies naar ander opioïd en/of andere toedieningsweg de omrekentabel in richtlijn Pijn in de palliatieve fase.
- Kies bij een gestoorde nierfunctie (klaring <50 ml/min) voor intermitterende toediening van morfine (zo nodig, op geleide van de klachten) of voor onderhoudsbehandeling met fentanyl of hydromorfon.
- Overweeg bij onvoldoende effect van morfine, zeker als angst en spanning een rol lijken te spelen, toevoeging van een benzodiazepine:
- oxazepam 3dd 10 mg of lorazepam 2dd 0,5 mg p.o. (bij een levensverwachting van weken tot maanden), of
- midazolam 10-30 mg/24 uur s.c. (bij een levensverwachting van dagen tot een week).
- Start met 1dd 4-8 mg dexamethason of 1dd 30-60 mg prednis(ol)on p.o., s.c. of i.v. bij:
- Exacerbatie van COPD
- Pneumonitis door radiotherapie of medicamenten
- Lymphangitis carcinomatosa
- V. cava superior-syndroom
- Obstructie van de luchtwegen
- Beoordeel het effect na een week.
- Zet palliatieve sedatie in bij refractaire dyspneu. Bij continue en diepe sedatie dient de levensverwachting <1-2 weken te zijn. Bij dreigende verstikking wordt acute sedatie toegepast. Gebruik de middelen en doseringen die vermeld worden in de KNMG-richtlijn Palliatieve sedatie.
*In de thuissituatie kunnen pompen in gebruik zijn, waarbij doseringen alleen gegeven kunnen worden in veelvouden van 12 mg/24 uur. In dat geval is de startdosering 12 mg/24 uur en wordt bij dosisverhogingen afgerond naar het dichtstbijzijnde veelvoud van 12 mg/24 uur.
Het literatuuronderzoek is beperkt tot studies bij patiënten met kanker in de palliatieve fase of vergevorderde stadia van COPD of hartfalen.
Beschrijving van de studies
Systematische reviews
De search identificeerde negen systematische reviews die het effect bestudeerden van medicamenteuze behandeling bij patiënten met dyspneu en kanker in de palliatieve fase, of vergevorderde stadia van COPD of hartfalen. Drie reviews gaan specifiek over patiënten met kanker [Ben-Aharon 2012, DiSalvo 2008, Viola 2008], één review over COPD [Marciniuk 2011], één review over longziekten [Bailey 2010], en vier reviews over een mix van aandoeningen [Jennings 2001, Simon 2013, Simon 2010, Lorenz 2008]. De meeste reviews gaan over een brede waaier aan (medicamenteuze) interventies [Ben-Aharon 2012, Marciniuk 2011, Bailey 2010, DiSalvo 2008, Lorenz 2008, Viola 2008], terwijl één review specifiek handelt over opioïden [Jennings 2001], één review over fentanyl [Simon 2013] en één review over benzodiazepines [Simon 2010].
Voor de behandeling van dyspneu bij patiënten met kanker in de palliatieve fase is de review van Ben-Aharon et al. de meest recente en volledige wat betreft opioïden [Ben-Aharon 2012], en wordt deze review dan ook als uitgangspunt gebruikt. Simon et al vonden geen vergelijkende studies over behandeling met fentanyl [Simon 2013]. Wat betreft benzodiazepines is de review van Simon et al. de meest volledige [Simon 2010]. Over corticosteroïden werden geen reviews gevonden.
Voor de behandeling van dyspneu bij patiënten met vergevorderde stadia van COPD is de review van Jennings et al. de meest volledige wat betreft opioïden [Jennings 2001]. Simon et al. identificeerden nog één extra studie over fentanyl [Simon 2013], terwijl Marciniuk nog een extra studie vond over morfine [Marciniuk 2011]. Wat betreft benzodiazepines is de review van Simon et al. de meest volledige [Simon 2010]. Over corticosteroïden werden geen reviews gevonden die resultaten rapporteren specifiek voor gevorderde stadia.
Voor de behandeling van dyspneu bij patiënten met vergevorderde stadia van hartfalen is de review van Jennings et al. de meest volledige wat betreft opioïden [Jennings 2001]. Simon et al. vonden geen studies over benzodiazepines [Simon 2010]. Over corticosteroïden werden geen systematische reviews gevonden.
De reviews van Bailey et al., Lorenz et al. en DiSalvo et al. includeerden geen extra studies ten opzichte van de andere reviews en worden daarom verder niet besproken [Bailey 2010, Lorenz 2008, DiSalvo 2008].
RCT's en controlled clinical trials
De search identificeerde aanvullend nog vier RCT's en één gecontroleerde studie die niet in één van de hiervoor vermelde reviews geïncludeerd werden.
Drie RCT's evalueerden het effect van opioïden bij patiënten met kanker [Gamborg 2013, Cuervo Pinna 2014, Hui 2014].
Gamborg et al. randomiseerden in een dubbelblinde, dubbel-dummy opzet 20 patiënten met een vergevorderd stadium van longkanker of longmetastasen en dyspneu in rust, die behandeld werden met morfine, tussen oraal toegediend morfine (1/12e van de dagdosis) of subcutaan toegediende morfine (1/18e van de dagdosis) [Gamborg 2013]. Het primaire eindpunt was dyspneu in rust, gemeten met een visueel analoge schaal (VAS) 60 minuten na toediening.
Cuervo Pinna et al. vergeleken met een cross-over design oraal transmucosaal fentanylcitraat (OTFC) met placebo bij 13 patiënten met een vergevorderd stadium van kanker (waarvan 10 patiënten met longkanker) en matige inspanningsdyspneu [Cuervo Pinna 2014]. Het primaire eindpunt was dyspneu, gemeten met een numeric rating scale (NRS) na 6 minuten tijdens een gestandaardiseerde looptest.
Hui et al. randomiseerden 20 patiënten met diverse soorten kanker (65% stadium IV) en aanvalsgewijze dyspneu tussen subcutaan toegediend fentanyl of placebo [Hui 2014]. De patiënten ondergingen twee achtereenvolgende looptesten van 6 minuten (één zonder medicatie en één met fentanyl of placebo (toegediend 15 minuten voor de tweede looptest)). Het primaire eindpunt was het percentage patiënten dat twee looptesten kon voltooien. Dyspneu, gemeten met een NRS en loopafstand waren secundaire uitkomstmaten.
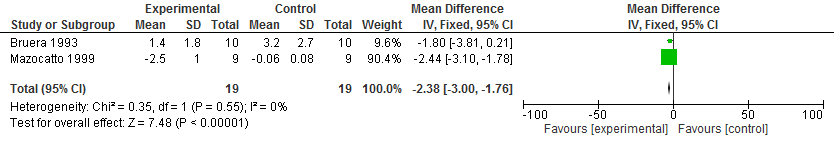
Figuur 1. Effect op dyspneu van subcutaan morfine versus placebo bij patiënten met kanker
Eén cross-over RCT vergeleek het effect van een korte behandeling (i.e. 4 dagen) met oraal toegediend morfine (20 mg/dag) versus oraal toegediend oxycodon (10 mg/dag) versus placebo bij 35 patiënten met stabiel chronisch hartfalen en een NYHA klasse III-IV [Oxberry 2011]. Het primaire eindpunt was verandering van dyspneu na 4 dagen in vergelijking met baseline, gemeten met een NRS. Dyspneu werd tevens gemeten met de Borg schaal. Aan het einde van deze studie werd de (nog steeds geblindeerde) patiënten gevraagd naar hun voorkeur. Als ze kozen voor morfine of oxycodon konden ze in een open-label verlenging van deze studie kiezen om door te gaan met het middel van hun keuze (de opioïdgroep). Deze groep werd vergeleken met een groep die een voorkeur uitsprak voor placebo of niet door wilde gaan met de studiemedicatie (de nonopioïdgroep) [Oxberry 2013]. Twintig patiënten gebruikten een opioïd (morfine of oxycodon) en dertien patiënten geen medicatie (nonopioïd groep). Het primaire eindpunt was het verschil in de NRS voor dyspneu tussen baseline en drie maanden.
Voor COPD werden aanvullend geen RCT's of gecontroleerde studies gevonden.
Kwaliteit van het bewijs
De twee Cochrane reviews zijn van goede kwaliteit [Jennings 2001, Simon 2010]. Beide reviews deden een uitgebreide search naar studies, met expliciete rapportering van de gebruikte methodologie en resultaten. De meeste andere reviews hebben een matige kwaliteit, voornamelijk door de gebrekkige rapportering van de resultaten van de kwaliteitsbeoordeling [Ben-Aharon 2012, Marciniuk 2011, Simon 2013, Lorenz 2008, Viola 2008, DiSalvo 2008, Bailey 2010].
Van de vier recentere gerandomiseerde studies heeft er één studie een onduidelijk risico op bias door een ontbreken van een beschrijving van de randomisatie en allocation concealment [Cuervo Pinna 2014]. De drie andere RCT's hebben een hoog risico op bias door het ontbreken van een intention-to-treat analyse [Oxberry 2011] of selectieve rapportering van de resultaten [Gamborg 2013, Hui 2014]. De open-label trial van Oxberry et al. heeft eveneens een hoog risico op bias door het ontbreken van randomisatie en blindering [Oxberry 2013].
Effect op dyspneu: kritische uitkomstmaat
Opioïden
Kanker
Ben-Aharon et al. includeerden drie RCT's (bij een totaal van 116 patiënten met kanker, voornamelijk met longkanker of -metastasen) die verneveld morfine (2 studies) of verneveld hydromorfon (1 studie) vergeleken met placebo (verneveld fysiologisch zout) [Ben-Aharon 2012]. Twee studies hadden een cross-over design. In geen enkele studie werd een significant verschil gevonden in het effect op dyspneu. Een meta-analyse van deze drie studies was niet mogelijk.
Twee cross-over RCT's (bij een totaal van 19 patiënten met kanker) vergeleken subcutaan toegediend morfine met placebo [Ben-Aharon 2012]. Eén studie liet een significant gewogen gemiddeld verschil zien in dyspneu (-2,44, 95% BI -3,10 tot -1,78), terwijl de andere studie geen significant verschil liet zien (-1.80, 95% BI -3,81 tot 0,21). Een meta-analyse (Review Manager versie 5.3) van deze twee studies toonde een significant effect (zie figuur 1; gemiddeld verschil -2,38; 95% BI ‑3,00 tot -1,76).
Figuur 1. Effect op dyspneu van subcutaan morfine versus placebo bij patiënten met kanker.
Eén cross-over RCT vergeleek verneveld hydromorfon met subcutaan/oraal hydromorfon of verneveld fysiologisch zout bij 25 patiënten met kanker [Ben-Aharon 2012]. Zowel verneveld hydromorfon als subcutaan of oraal hydromorfon hadden geen significant effect op dyspneu in vergelijking met verneveld fysiologisch zout (gewogen gemiddeld verschil: verneveld hydromorfon: -0,56; 95% BI ‑1,61 tot 0,49; subcutaan of oraal hydromorfon: -0,47; 95% BI -1,48 tot 0,54).
Eén cross-over RCT vergeleek verneveld morfine met subcutaan toegediend morfine bij 12 patiënten met kanker [Ben-Aharon 2012]. Er werd geen significant verschil gevonden in het effect op dyspneu.
Eén RCT vergeleek een dosis van 25% met een dosis van 50% van de reguliere 4-uurs dosis oraal of subcutaan morfine bij 33 patiënten met kanker [Ben-Aharon 2012]. Er werd geen significant verschil gevonden in het effect op dyspneu.
Gamborg et al. vergeleken oraal met subcutaan toegediende morfine bij 20 patiënten met een vergevorderd stadium van longkanker of longmetastasen en dyspneu in rust [Gamborg 2013]. In beide groepen trad een significante afname van de dyspneu na 60 minuten op. De VAS-score na 60 minuten was hoger met oraal toegediende morfine in vergelijking met subcutaan toegediende morfine (4,4 vs. 3,0), maar een statistische vergelijking werd niet gerapporteerd.
Cuervo Pinna et al. vergeleken met een cross-over design (buccaal toegediend fentanyl (OTFC) met placebo bij 13 patiënten met gevorderde stadia van kanker [Cuervo Pinna 2014]. Er werden geen significant verschillen gevonden in het effect op dyspneu na 3 minuten (NRS 4,3 vs. 5,1; p=0,13), na 6 minuten (4,5 vs. 5,5; p=0,3), 30 minuten na de looptest (3,0 vs. 3,4; p=0,53) en 60 minuten na de looptest (2,4 vs. 2,6; p=0,56).
Hui et al. vergeleken subcutaan toegediend fentanyl met placebo bij 20 patiënten met kanker en aanvalsgewijze dyspneu [Hui 2014]. Subcutaan toegediend fentanyl resulteerde in een significant verschil tussen de gemiddelde NRS-score voor dyspneu direct na de tweede looptest (na behandeling met fentanyl) en die na de eerste looptest (zonder fentanyl) (-1,8, 95% BI -3,2 tot -0,4). Het verschil bij placebo was niet significant (-2, 95% BI -4 tot 0,02). De baseline NRS-score voor dyspneu bij de tweede looptest (15 minuten na toediening van fentanyl) was 0,9 (95% BI 0,04 tot 1,8) lager dan bij de eerste looptest. Het verschil bij placebo was niet significant (0,7, 95% BI -0,1 tot 1,5). De vergelijking tussen fentanyl en placebo toonde geen significante verschillen (hoewel er geen p-waarde werd gerapporteerd).
COPD
Jennings et al. includeerden negen cross-over RCT's die het effect op dyspneu rapporteerden van opioïden (dihydrocodeïne of (dia)morfine) versus placebo bij patiënten met vergevorderde stadia van COPD (N=160) [Jennings 2001]. Er werd geen significant verschil gevonden in het effect op dyspneu wanneer de zeven studies met oraal/parenteraal toegediende opioïden gecombineerd werden met de twee studies over verneveld morfine (gestandaardiseerd gemiddeld verschil = ‑0,26; 95% BI -0,44 tot 0,08). Een meta-analyse van negen studies met oraal/parenteraal toegediende opioïden (waarvan zeven studies bij COPD-patiënten) toonde wel een significant effect op dyspneu (gestandaardiseerd gemiddeld verschil ‑0,40; 95% BI -0,63 tot -0,17), in tegenstelling tot de meta-analyse van drie studies over verneveld morfine (waarvan twee studies bij COPD-patiënten) (gestandaardiseerd gemiddeld verschil ‑0,11; 95% BI ‑0,32 tot 0,10).
Marciniuk et al. vonden nog één bijkomende cross-over RCT die morfine met vertraagde afgifte vergeleek met placebo bij 48 patiënten met refractaire dyspneu (88% COPD) [Marciniuk 2011]. Morfine had in deze studie een significant effect op dyspneu in vergelijking met placebo (gemiddeld verschil op VAS-schaal: ochtend 6,6 (95% BI 1,6 tot 11,6; p=0,011); avond: 9,5 (95% BI 3,0 tot 16,1; p=0,006)).
Simon et al. includeerden een studie bij 12 patiënten met COPD waarbij een eenmalige toediening van verneveld fentanyl werd vergeleken met placebo [Simon 2013]. Er was geen verschil in dyspneu tijdens een looptest tussen beide groepen.
Hartfalen
Jennings et al. includeerden één cross-over RCT die het effect van een eenmalige toediening van dihydrocodeïne vergeleek met placebo bij 12 patiënten met hartfalen (NYHA klasse II-III) [Jennings 2001]. Er werd een significant effect op dyspneu gevonden ten voordele van dihydrocodeïne (gestandaardiseerd gemiddeld verschil -0,85; 95% BI -1,28 tot -0,42).
Viola et al. identificeerden nog een andere cross-over RCT die het effect van oraal toegediend morfine vergeleek met placebo bij tien patiënten met hartfalen (NYHA klasse III-IV) [Viola 2008]. De dyspneuscores (gemeten op een VAS schaal) na 4 dagen bedroegen 13 in de morfinegroep versus 47 in de placebogroep, maar een p-waarde voor het verschil werd niet gerapporteerd.
Oxberry et al. vergeleken het effect van een korte behandeling (i.e. 4 dagen) van oraal toegediend morfine, oraal toegediend oxycodon en placebo bij 35 patiënten met stabiel chronisch hartfalen en een NYHA klasse III-IV [Oxberry 2011]. Er werden geen significante verschillen in het effect op dyspneu gevonden tussen de drie groepen.
In de vervolgstudie werden significante verschillen in afname van NRS-scores na 3 maanden gevonden tussen de opioïdgroep en de non-opioïdgroep [Oxberry 2013]:
- gemiddelde verandering in gemiddelde NRS: 2,0 vs. 0 (p=0,033)
- gemiddelde verandering in maximale NRS: 0,54 vs. 0,15 (p=0,006)
De verschillen in Borg scores voor dyspneu waren niet significant.
Benzodiazepines
Kanker
Simon et al. includeerden drie RCT's (met een totaal van 190 patiënten met gevorderde kanker) die benzodiazepines (lorazepam of midazolam) vergeleken met placebo (één cross-over RCT) of morfine (twee RCT's met parallel design) [Simon 2010]. Er werd geen significant verschil gevonden tussen lorazepam en placebo in het effect op dyspneu (gestandaardiseerd gemiddeld verschil -0,06; 95% BI ‑0,73 tot 0,62). Er werd ook geen significant verschil gevonden tussen midazolam en morfine in het effect op dyspneu (gestandaardiseerd gemiddeld verschil -0,68; 95% BI -2,21 tot 0,84) of aanvalsgewijze dyspneu (relatief risico 0,76; 95% BI 0,53 tot 1,09) en evenmin tussen de combinatie van morfine s.c. + midazolam s.c. versus morfine s.c. (gestandaardiseerd gemiddeld verschil 0,03) 95% BI -0,54 tot 0,61).
COPD
Simon et al. includeerden vier cross-over RCT's (bij een totaal van 64 patiënten met vergevorderde stadia van COPD) die benzodiazepines (clorazepaat, alprazolam of diazepam) vergeleken met placebo [Simon 2010]. Drie studies werden opgenomen in een meta-analyse, die geen significant verschil in effect op dyspneu toonde tussen benzodiazepines en placebo (gestandaardiseerd gemiddeld verschil -0,16; 95% BI -0,73 tot 0,40).
Hartfalen
Simon et al. identificeerden geen RCT's die patiënten met hartfalen includeerden [Simon 2010].
Effect op kwaliteit van leven: kritische uitkomstmaat
Geen enkele review bij patiënten met kanker of COPD rapporteerde over het effect op kwaliteit van leven.
Viola et al. includeerden één cross-over RCT die het effect van oraal toegediend morfine vergeleek met placebo bij tien patiënten met hartfalen (NYHA klasse III-IV) [Viola 2008]. De kwaliteit van leven (gemeten op een VAS schaal) na 4 dagen bedroeg 32 in de morfinegroep versus 46 in de placebogroep, maar een p-waarde werd niet gerapporteerd.
Een andere cross-over RCT rapporteerde over het effect van morfine versus oxycodon versus placebo op de kwaliteit van leven (gemeten met de SF-12 schaal) bij 35 patiënten met hartfalen (NYHA-klasse III-IV) [Oxberry 2011]. Er werden geen significante verschillen gevonden tussen de verschillende behandelgroepen.
Effect op fysiek functioneren: kritische uitkomstmaat
Geen enkele review of RCT rapporteerde over het effect op fysiek functioneren.
Effect op inspanningstolerantie: kritische uitkomstmaat
Opioïden
Kanker
Cuervo Pinna et al. vonden geen significant verschil in de loopafstand tijdens een 6-minuten looptest tussen buccaal toegediend fentanyl (OTFC) en placebo bij 13 patiënten met gevorderde stadia van kanker [Cuervo Pinna 2014].
Hui et al. vonden een significant verschil in loopafstand tussen de eerste (zonder medicatie) en de tweede (na toediening van fentanyl) looptest (37,2, 95% BI 5,8 tot 68,6) [Hui 2014]. Bij placebo was het verschil niet significant (18,9, 95% BI -10,4 tot 48,2).
Een directe vergelijking tussen fentanyl en placebo toonde geen significante verschillen.
COPD
Jennings et al. includeerden tien cross-over RCT's die het effect op inspanningstolerantie (loopafstand) rapporteerden van opioïden versus placebo in patiënten met vergevorderde stadia van COPD (N=98) [Jennings 2001]. Er werd geen significant verschil gevonden wanneer de zeven studies over oraal/parenteraal toegediende opioïden gecombineerd werden met de drie studies over verneveld morfine (gestandaardiseerd gemiddeld verschil 0,19; 95% BI -0,05 tot 0,43). Een meta-analyse van acht studies over oraal/parenteraal toegediende opioïden (waarvan zeven studies bij COPD-patiënten) toonde eveneens geen significant effect (gestandaardiseerd gemiddeld verschil 0,22; 95% BI -0,03 tot 0,47).
Simon et al. includeerden een studie bij 12 patiënten met COPD waarbij een eenmalige toediening van verneveld fentanyl werd vergeleken met placebo [Simon 2013]. De patiënten die met fentanyl waren behandeld konden de inspanningstest significant langer volhouden (verschil 1.30 + 0,43 minuten, p=0.01).
Hartfalen
Jennings et al. includeerden één cross-over RCT die het effect van dihydrocodeïne vergeleek met placebo bij 12 patiënten met hartfalen (NYHA klasse II-III) [Jennings 2001]. Een significant effect op inspanningstolerantie werd gevonden ten voordele van dihydrocodeïne (gestandaardiseerd gemiddeld verschil 0,61; 95% BI 0,34 tot 0,88).
Benzodiazepines
Geen enkele RCT rapporteerde over het effect van benzodiazepines op de inspanningstolerantie.
Kanker in de palliatieve fase
Er is bewijs van matige kwaliteit dat subcutaan toegediend morfine een effect heeft op dyspneu in vergelijking met placebo bij patiënten met kanker in de palliatieve fase.
Ben-Aharon 2012
Er is bewijs van matige kwaliteit dat systemisch toegediend hydromorfon en verneveld hydromorfon niet effectiever zijn dan placebo met betrekking tot het effect op dyspneu bij patiënten met kanker in de palliatieve fase.
Ben-Aharon 2012
Er is bewijs van matige kwaliteit dat verneveld morfine geen effect heeft op dyspneu in vergelijking met placebo bij patiënten met kanker in de palliatieve fase.
Ben-Aharon 2012
Er is bewijs van lage kwaliteit dat verneveld morfine hetzelfde effect heeft op dyspneu als subcutaan toegediend morfine bij patiënten met kanker in de palliatieve fase.
Ben-Aharon 2012
Er is bewijs van matige kwaliteit dat 25% van de reguliere 4-uurs dosis oraal of subcutaan toegediend morfine hetzelfde effect heeft op dyspneu als 50% van de reguliere 4-uurs dosis morfine bij patiënten met kanker in de palliatieve fase.
Ben-Aharon 2012
Er is bewijs van lage kwaliteit dat buccaal of subcutaan toegediend fentanyl geen effect heeft op dyspneu in vergelijking met placebo bij patiënten met kanker in de palliatieve fase.
Cuervo Pinna 2014, Hui 2014
Er is bewijs van lage kwaliteit dat lorazepam geen effect heeft op dyspneu in vergelijking met placebo bij patiënten met kanker in de palliatieve fase.
Simon 2010
Er is bewijs van lage kwaliteit dat er geen verschil is tussen morfine en midazolam met betrekking tot hun effect op dyspneu.
Simon 2010
Er is bewijs van lage kwaliteit dat de combinatie van subcutaan midazolam en morfine geen effect heeft op dyspneu in vergelijking met subcutaan toegediend midazolam of subcutaan toegediend morfine alleen.
Simon 2010, Ben-Aharon 2012
Er is bewijs van lage kwaliteit dat buccaal of subcutaan toegediend fentanyl geen effect heeft op de inspanningstolerantie in vergelijking met placebo bij patiënten met kanker in de palliatieve fase.
Cuervo Pinna 2014, Hui 2014
Over het effect van corticosteroïden op dyspneu, kwaliteit van leven of inspanningstolerantie bij patiënten met kanker in de palliatieve fase kan geen uitspraak worden gedaan.
Vergevorderde stadia van COPD
Er is bewijs van lage kwaliteit dat oraal of subcutaan toegediende opioïden (dihydrocodeine en (dia)morfine) een effect hebben op dyspneu in vergelijking met placebo bij patiënten met vergevorderde stadia van COPD.
Jennings 2001, Marciniuk 2011
Er is bewijs van lage kwaliteit dat verneveld morfine geen effect heeft op dyspneu in vergelijking met placebo bij patiënten met vergevorderde stadia van COPD.
Jennings 2001
Er is bewijs van lage kwaliteit dat verneveld fentanyl geen effect heeft op dyspneu in vergelijking met placebo bij patiënten met vergevorderde stadia van COPD.
Simon 2013
Er is bewijs van lage kwaliteit dat benzodiazepines (clorazepaat, alprazolam en diazepam) geen effect hebben op dyspneu in vergelijking met placebo bij patiënten met vergevorderde stadia van COPD.
Simon 2010
Er is bewijs van lage kwaliteit dat opioïden (dihydrocodeïne en (dia)morfine) geen effect hebben op de inspanningstolerantie in vergelijking met placebo bij patiënten met vergevorderde stadia van COPD.
Jennings 2001
Er is bewijs van lage kwaliteit dat verneveld fentanyl een effect heeft op de inspanningstolerantie in vergelijking met placebo bij patiënten met vergevorderde stadia van COPD.
Simon 2013
Over het effect van corticosteroïden op dyspneu, kwaliteit van leven of inspanningstolerantie bij patiënten met vergevorderde stadia van COPD kan geen uitspraak worden gedaan.
Vergevorderde stadia van hartfalen
Er is conflicterend bewijs over het effect van opioïden (dihydrocodeïne, morfine en oxycodon) op dyspneu in vergelijking met placebo of geen behandeling bij patiënten met vergevorderde stadia van hartfalen.
Jennings 2001, Viola 2008, Oxberry 2011
Er is bewijs van matige kwaliteit dat opioïden (dihydrocodeïne, morfine en oxycodon) geen effect hebben op kwaliteit van leven in vergelijking met placebo bij patiënten met vergevorderde stadia van hartfalen.
Viola 2008, Oxberry 2011
Er is bewijs van lage kwaliteit dat dihydrocodeïne een effect heeft op de inspanningstolerantie in vergelijking met placebo bij patiënten met vergevorderde stadia van hartfalen.
Jennings 2001
Over het effect van benzodiazepines op dyspneu, kwaliteit van leven of inspanningstolerantie bij patiënten met vergevorderde stadia van hartfalen kan geen uitspraak worden gedaan.
Over het effect van corticosteroïden op dyspneu, kwaliteit van leven of inspanningstolerantie bij patiënten met vergevorderde stadia van hartfalen kan geen uitspraak worden gedaan.
Algehele kwaliteit van bewijs = matig tot laag
In tabel 1 staan de belangrijkste conclusies kort weergegeven.
| Effect op | ||||
| Middel | Dyspneu | Kwaliteit van leven | Fysiek functioneren | Inspannings-tolerantie |
| Kanker in de palliatieve fase | ||||
| Morfine s.c. versus placebo | +1 | |||
| Morfine verneveld versus placebo | -1 | |||
| Morfine s.c. versus verneveld | -2 | |||
| Morfine s.c. versus midazolam s.c. | -2 | |||
| Morfine s.c. + midazolam s.c. versus morfine s.c. | -2 | |||
| Fentanyl buccaal of s.c. versus placebo | -2 | -2 | ||
| Hydromorfon s.c. of verneveld versus placebo | -1 | |||
| Lorazepam versus placebo | -2 | |||
| Corticosteroïden | ||||
| COPD | ||||
| Dihydrocodeine of (dia)morfine versus placebo | +2 | -2 | ||
| Morfine verneveld versus placebo | -2 | |||
| Fentanyl verneveld versus placebo | -2 | +2 | ||
| Clorazepaat/alprazolam/diazepam versus placebo | -2 | |||
| Corticosteroïden | ||||
| Hartfalen | ||||
| Dihydrocodeine/morfine/oxycodon versus placebo | +/-1 | -1 | +2 (dihydrocodeine) | |
| Benzodiazepines | ||||
| Corticosteroïden | ||||
+ Significant verschil ten voordele van eerstgenoemde middel
- Geen significant verschil
+/- Conflicterende resultaten
1 Bewijs van matige kwaliteit
2 Bewijs van lage kwaliteit
Lege vakjes Geen vergelijkende studies
In het onderstaande wordt ingegaan op de overwegingen bij de rol van medicamenteuze behandeling (opioïden, corticosteroïden, benzodiazepines en andere medicatie) van dyspneu.
Er zijn diverse richtlijnen op het gebied van dyspneu van:
- de Long Alliantie Nederland (alleen bij COPD),
- de Canadian Thoracic Society (alleen bij COPD),
- de American College of Chest Physicans (zowel bij longziekte/hartfalen als bij longkanker),
- Clinical Care Ontario (alleen bij kanker),
- het Leitlinienprogramm Onkologie (alleen bij kanker),
- de Scottish Palliative Care Guidelines (bij dyspneu, ongeacht de aard van de onderliggende ziekte) en
- de American College of Physicians (bij dyspneu tegen het einde van het leven, ongeacht de aard van de onderliggende ziekte)
[Long Alliantie Nederland 2011, Marciniuk 2011, Mahler 2010a en 2010b, Kvale 2007, Clinical Care Ontario 2010, Leitlinienprogramm Onkologie 2014, NHS Scotland 2014, Qaseem 2008].
Hoewel vrijwel alle literatuur betrekking heeft op patiënten met kanker en COPD, ziet de werkgroep geen reden waarom ondergenoemde middelen niet ingezet zouden kunnen of moeten worden bij patiënten met dyspneu op basis van vergevorderde stadia van hartfalen of andere aandoeningen. In de aanbevelingen wordt derhalve gesproken van ‘dyspneu in de palliatieve fase'.
Een pilotstudie bij 6 patiënten met ALS suggereerde dat morfine veilig en effectief is bij de behandeling van dyspneu bij deze ziekte [Clemens 2008]. Er werd geen systematisch onderzoek gevonden van het effect van opioïden op dyspneu bij andere dan bovengenoemde aandoeningen.
Opioïden
Placebo-gecontroleerde studies laten een gemiddeld verschil in dyspneu tussen opioïden en placebo zien van 1 punt op een schaal van 0-10 of 10 mm op een schaal van 100 mm [Jennings 2001, Abernethy 2003]. Onderzoek laat zien dat dit verschil weliswaar klein, maar klinisch relevant is [Johnson 2013].
Opioïden versus zuurstof
In een niet-gerandomiseerde studie bij 46 patiënten met kanker werd het effect van toediening van morfine of hydromorfon op dyspneu bestudeerd met en zonder toediening van 4 l zuurstof/minuut [Clemens 2009]. Toediening van zuurstof had geen effect op dyspneu, terwijl er na toediening van een opioïd een significante afname van dyspneu optrad. Hoewel er geen sprake was van een gerandomiseerd onderzoek met een directe vergelijking, suggereert de studie wel dat opioïden meer effect hebben op dyspneu dan toediening van zuurstof.
De werkgroep is van mening dat al primaire behandeling van dyspneu in de palliatieve fase morfine de voorkeur heeft boven zuurstof.
Keuze van het opioïd
Alle richtlijnen adviseren het gebruik van oraal of parenteraal toegediende opioïden bij dyspneu bij kanker in de palliatieve fase [Cancer Care Ontario 2010, Kvale 2007, Leitlinienprogramm Onkologie 2014, Qaseem 2008], COPD [Long Alliantie Nederland 2011, Mahler 2010a en 2010b, Marciniuk 2011] en hartfalen [Mahler 2010a en 2010b] of ongeacht de aard van de ziekte [NHS Scotland 2014, Qaseem 2008].
Een aantal richtlijnen raadt expliciet het gebruik van verneveld morfine af [Marciniuk 2011, Mahler 2010a en 2010b, Clinical Care Ontario 2010].
Hoewel er vrijwel alleen evidentie is voor dihydrocodeine en morfine, specificeren de meeste richtlijnen niet dat er een voorkeur is voor een specifiek opioïd. De richtlijnen van Cancer Care Ontario en van de Long Alliantie Nederland noemen in hun aanbevelingen alleen morfine [Cancer Care Ontario 2010, Long Alliantie Nederland 2011]. De richtlijn van het Leitlinienprogramm Onkologie adviseert primair morfine, maar stelt expliciet dat ze er op basis van de klinische praktijk van uitgaan dat andere opioïden ook effectief zijn tegen dyspneu [Leitlinienprogramm Onkologie 2014]. De richtlijn van de NHS Scotland adviseert morfine als eerste keusmiddel bij opioidnaïeve patiënten, meer geeft aan dat als de patiënt al een opioïd gebruikt, de dosering hiervan opgehoogd kan worden [NHS Scotland 2014].
De werkgroep is van mening dat op basis van de beschikbare evidentie morfine het middel van eerste keuze is, maar sluit (bij gebrek aan adequate studies) het effect van andere opioïden (vooral fentanyl en oxycodon) niet uit.
Onderhoudsbehandeling met morfine is gecontra-indiceerd bij een gestoorde nierfunctie (klaring <50 ml/min) in verband met het risico op stapeling. Daarom wordt continue infusie of intermitterende toediening van morfine met vaste intervallen ontraden. Het risico van stapeli is bij oxycodon minder en bij fentanyl en hydromorfon niet aanwezig; deze middelen zijn daarom meer geschikt voor onderhoudsbehandeling van dyspneu bij patiënten met een klaring van <50 ml/min. Eventueel kan morfine wel zo nodig worden voorgewchreven. Wanneer het effect is uitgewerkt kan opnieuw een dosis worden gegeven.
De orale toedieningsweg heeft (om praktische redenen) de voorkeur. Indien een snel effect gewenst is wordt intermitterende of continue parenterale (subcutane of intraveneuze) toediening aanbevolen [Kim 2013].
Indien de patiënt reeds morfine in verband met pijn gebruikt, wordt in de literatuur aanbevolen om de dosering met stappen van 25-50% te verhogen.
Indien de patiënt reeds een ander opioïd in verband met pijn gebruikt (bijvoorbeeld fentanyl, oxycodon of hydromorfon) gebruikt zijn drie strategieën mogelijk:
- De dosering van het opioïd met 25-50% verhogen;
- De dosering van het opioïd niet veranderen en morfine bijgeven, waarbij gekozen kan worden voor slow release of immediate release morfine in bovengenoemde doseringsschema's voor opioïdnaïeve patiënten;
- Roteren naar morfine, waarbij wordt gestart met de equi-analgetische dosis.
De werkgroep heeft een voorkeur voor de derde mogelijkheid, zeker als de pijn niet goed onder controle is en/of er sprake is van hinderlijke bijwerkingen.
Doseringsschema en toedieningsweg
De meeste richtlijnen geven geen aanbevelingen voor het doseringsschema, De Long Alliantie Nederland adviseert een startdosis van 4-6 dd 5 mg immediate release morfine [Long Alliantie Nederland 2011]. Bij onvoldoende effect wordt de dosering in stappen van 50% opgehoogd. Indien de effectieve dagdosis gevonden is, wordt overgegaan op slow release morfine, waarbij 2dd 50% van de dagdosis wordt gegeven. Voor ‘aanvalsgewijze dyspneu' wordt vaak15% van de dagdosis als immediate release morfine gegeven. De richtlijn van Cancer Care Ontario adviseert een startdosis van 6dd 5 mg immediate release morfine met 2,5 mg voor aanvalsgewijze dyspneu [Cancer Care Ontario 2010]. De richtlijn van het Leitlinienprogramm Onkologie adviseert om te starten met 6dd 2,5-5 mg en de richtlijn van de NHS Scotland met 4-6dd 2 mg [Leitlinienprogramm Onkologie 2014, NHS Scotland 2014].
Als duidelijk is welke dagdosis effectief is voor de bestrijding van de dyspneu, kan overgegaan worden op slow release morfine (waarbij 2dd de helft van de effectieve dagdosis gegeven wordt).
Mede gelet op het ontbreken van meerwaarde van titreren met immediate release morfine bij pijn kan er ook voor gekozen worden om direct te starten met slow release morfine.
In een van de meest recente gerandomiseerde studies bij 48 opioïdnaïeve patiënten werd gestart met een dosis van 1dd 20 mg slow release morfine [Abernathy 2003]. In een recente fase II dose-finding studie bij 83 patiënten met chronische dyspneu werd gestart met 1dd 10 mg slow release morfine [Currow 2011, Currow 2013]. Bij onvoldoende effect werd opgehoogd in stappen van 10 mg/dag. Bij 62% van de patiënten gaf slow release morfine voldoende verlichting van de dyspneu (Number Needed tot Treat (NNT) 1,6). Bij 67% van de responders was 10 mg/dag voldoende, bij 27% 20 mg/dag en bij 6% 30 mg/dag. Van de responders had 53% na drie maanden nog steeds baat bij de behandeling.
Een recente review van dezelfde auteurs adviseerde 1dd 10 mg slow release morfine als startdosering [Currow 2014].
Desondanks adviseert de werkgroep een startdosering van 2dd 10 mg slow release morfine. Argumenten hiervoor zijn:
- Het is farmacologisch rationeler om slow release morfine 2x daags te doseren.
- Het is verwarrend een andere doseringsfrequentie van morfine te gebruiken dan bij de behandeling van pijn (waarbij slow release opioïden standaard 2dd worden gegeven).
De werkgroep heeft een lichte voorkeur om direct te starten met slow release morfine, maar vindt het titreren met immediate release morfine een goed alternatief. Dat kan in eerste instantie alleen zo nodig worden toegediend, maar er kan ook voor een vast schema met toedieningen om de vier uur worden gekozen.
De werkgroep adviseert in beide gevallen om standaard immediate release morfine (in een dosering van 1/6 van de dagdosis, waarbij afgerond wordt naar het dichtstbij zijnde veelvoud van 5 mg) voor te schrijven voor aanvalsgewijze dyspneu, die naar verwachting langer dan 30 minuten zal aanhouden. Bij een startdosis van 2dd 10 mg impliceert dit een dosering van 5 mg immediate release. Er is gekozen voor 1/6 van de dagdosis, omdat de dosering dan precies overeenkomt met de 4-uurs dosering.
Indien gekozen wordt voor intermitterende toediening van morfine s.c. of i.v. worden bij opioïdnaïeve patiënten doseringen van 6dd 1-3 mg geadviseerd [Cancer Care Ontario 2010, Leitlinienprogramm Onkologie 2014, NHS Scotland 2014].
In het artikel van Kim bedroeg de mediane startdosering bij continue subcutane of intraveneuze toediening van morfine 25 mg/24 uur (range 10-75); de mediane maximale dosering was eveneens 25 mg/24 uur (range 15-200) [Kim 2013].
Behandeling van aanvalsgewijze dyspneu
In de literatuur worden geen adviezen gegeven over de behandeling van aanvalsgewijze dyspneu. Gelet op het feit dat het effect pas optreedt na circa 30 minuten, heeft toediening van immediate release morfine alleen zin bij langdurige aanvalsgewijze dyspneu of bij voorspelbare aanvalsgewijze dyspneu (waarbij de morfine 30-45 minuten tevoren wordt gegeven). Analoog aan de situatie bij doorbraakpijn, wordt gekozen voor 1/6 van de dagdosis morfine. Het gebruik van snelwerkende fentanylpreparaten (de zogenaamde rapid onset opioids die via het mond- of neusslijmvlies worden toegediend) voor de behandeling van aanvalsgewijze dyspneu wordt niet aanbevolen.
Indien een snel effect gewenst is, kan gekozen worden voor subcutane of intraveneuze toediening van morfine. Bij opioïdnaïeve patiënten wordt een dosering van 2,5 mg morfine s.c. of i.v. aanbevolen. Bij patiënten die al een opioïd gebruiken wordt 1/6 van de dagdosis aangehouden (omgerekend naar morfine en naar subcutane of intraveneuze toediening.
Bij dreigende verstikking of verbloeding zullen in het algemeen hogere doseringen morfine (10-20 mg) worden gebruikt.
Bijwerkingen en risico's
Sufheid, misselijkheid, braken en obstipatie zijn frequent optredende bijwerkingen van opioïden [Currow 2014, Viola 2008]. In de studie van Currow stopte 22% van de patiënten de morfine vanwege bijwerkingen (Number Needed to Harm 4,6) [Currow 2011].
In de richtlijn van de American College of Physicians wordt ademdepressie genoemd als mogelijke en gevreesde bijwerking van opioïden bij patiënten met COPD [Mahler 2010a]. In de richtlijnen van de Cancer Care Ontario en van de Long Alliantie Nederland wordt expliciet gesteld dat proportioneel gedoseerde opioïden geen risico geven op ademdepressie [Clinical Care Ontario 2010, Long Alliantie Nederland 2011]. Recent onderzoek laat zien dat laag gedoseerde opioïden bij patiënten met ernstige longaandoeningen niet geassocieerd zijn met een verhoogde kans op opname in een ziekenhuis of overlijden en niet leiden tot ademdepressie [Currow 2014, Ekstrom 2014, Lopez-Saca 2014].
Benzodiazepines
Benzodiazepines kunnen worden voorgeschreven in de gedachte dat angst en spanning van invloed zijn op dyspneu en dat door vermindering daarvan de intensiteit van de dyspneu kan afnemen. Op basis van de systematische review van Simon wordt monotherapie met benzodiazepines niet geadviseerd [Simon 2010]. Drie richtlijnen geven expliciet aan dat anxiolytica niet standaard moeten worden ingezet ter behandeling van dyspneu [Cancer Care Ontario 2010, Kvale 2007, Marciniuk 2011]. De richtlijn van de NHS Scotland adviseert lorazepam, diazepam of midazolam als niet-medicamenteuze behandeling en opioïden onvoldoende effect hebben en er ook sprake is van angst en paniek [NHS Scotland 2014]. De richtlijn van het Leitlinienprogramm Onkologie geeft aan dat benzodiazepines overwogen kunnen worden bij onvoldoende effect van opioïden [Leitlinienprogramm Onkologie 2014].
De in de reviews van Simon en Ben-Aharon besproken dubbelblinde gerandomiseerde studie van Navigante liet geen effect op dyspneuscores zien van de toevoeging van midazolam s.c. aan morfine s.c. [Navigante 2006]. Echter, wanneer aan patiënten gevraagd werd of ze verlichting van dyspneu ondervonden, gaf na 24 uur 92% van de patiënten die de combinatie kreeg een bevestigend antwoord versus 69% van de patiënten die alleen subcutaan morfine kregen (p=0,03). Na 48 uur bedroegen deze percentages resp. 96% vs. 87,5% (p-waarde niet vermeld).
Op basis van deze studie en op basis van de klinische praktijk kan overwogen worden om een benzodiazepine toe te voegen als behandeling met morfine onvoldoende effect heeft op de dyspneu, zeker wanneer de indruk bestaat dat angst van invloed is op de dyspneu [Ben-Aharon 2012, Leitlinienprogramm Onkologie 2014, Navigante 2006, NHS Scotland 2014, Simon 2010]. Daarbij kan bij patiënten met een korte levensverwachting (<1 week) conform de studie van Navigante [2006] gekozen worden voor midazolam s.c. Bij patiënten met een langere levensverwachting wordt gekozen voor oxazepam of lorazepam p.o., omdat dit in de dagelijkse praktijk de meest gebruikte benzodiazepines zijn. Het gebruik van diazepam wordt niet aangeraden vanwege de lange halfwaardetijd.
Benzodiazepines worden ook gebruikt in het kader van palliatieve sedatie. Daarbij wordt vaak gebruik gemaakt van midazolam.
Palliatieve sedatie kan worden ingezet als er sprake is van ondraaglijk lijden als gevolg van referactaire dyspneu (dat wil zeggen dyspneu, die niet goed behandelbaar is en/of waarbij de behandeling gepaard gaat met onaanvaardbare bijwerkingen) conform de KNMG-richtlijn Palliatieve Sedatie [Koninklijke Nederlandse Maatschappij ter Bevordering van de Geneeskunst 2009]. Bij continue en diepe sedatie dient de levensverwachting <1-2 weken te zijn. Acute sedatie wordt ingezet bij dreigende verstikking of verbloeding.
Corticosteroïden
Er zijn geen gerandomiseerde studies over het effect van corticosteroïden (prednis(ol)on of dexamethason) bij dyspneu.
In een recent artikel werd de rol van corticosteroïden besproken [Lin 2012]. In dit artikel worden astma, exacerbaties van COPD, pneumonitis door radio- of chemotherapie, lymphangitis carcinomatosa en v. cava superiorsyndroom als mogelijke indicaties genoemd.
In de richtlijnen worden als indicaties genoemd: exacerbatie COPD (al dan niet als comorbiditeit) [Clinical Care Ontario 2010, Kvale 2007], lymphangitis carcinomatosa [Leitlinienprogramm Onkologie 2014, NHS Scotland 2014], pneumonitis door radio- of chemotherapie [Kvale 2007] en obstructie van de luchtwegen door tumor [Leitlinienprogramm Onkologie 2014, NHS Scotland 2014]. De richtlijn van Clinical Care Ontario geeft aan dat er geen redenen zijn om corticosteroïden aan- of af te raden bij dyspneu [Clinical Care Ontario 2010]. In de overige richtlijnen wordt de rol van corticosteroïden niet besproken.
Er is geen reden om te veronderstellen dat er verschil zou zijn in het effect van (equivalente doseringen van) prednis(ol)o)n of dexamethason op dyspneu. Gebruikelijke doseringen zijn 1dd 4-8 mg dexamethason of 1dd 30-60 mg prednis(ol)on p.o., s.c. of i.v. Indien er na een week geen effect is opgetreden, worden de corticosteroïden gestaakt. Indien er wel een effect is, wordt geprobeerd de dosering geleidelijk te verminderen op geleide van de klachten en uiteindelijk zo mogelijk de corticosteroïden te staken.
Overige medicamenten
De systematische review van Jeba over de rol van verneveld furosemide includeerde twee RCT's bij respectievelijk 7 en 15 patiënten met kanker. Geen van beide studies toonde een effect aan van verneveling van furosemide. Het gebruik ervan wordt afgeraden door de richtlijn van Clinical Care Ontario [Clinical Care Ontario 2010].
Vernevelen met acetylcysteïne wordt in de praktijk gebruikt als er sprake is van dyspneu en taai Ios sputum. Er is geen onderbouwing door onderzoek en de werkgroep is van mening dat in de praktijk blijkt dat het niet effectief is. Bovendien ruikt het zeer onaangenaam.
