-
Verstandelijke beperking, palliatieve zorg voor mensen
-
Inleiding
-
Markering
-
Kenmerken van palliatieve zorg bij mensen met een verstandelijke beperking
-
Syndroomspecifieke kenmerken
-
22q11.2 deletiesyndroom
-
CHARGE-syndroom
-
Cornelia de Lange syndroom
-
Downsyndroom
-
Foetaal alcoholsyndroom
-
Fragiele X syndroom
-
Neurofibromatose 1
-
Noonan syndroom
-
Prader-Willi syndroom
-
Rett syndroom en andere MECP2- gerelateerde stoornissen
-
Tubereuze sclerose complex
-
Williams-Beuren syndroom
-
Angelman syndroom
-
22q11.2 deletiesyndroom
-
Syndroomspecifieke kenmerken
-
Communicatie tijdens de palliatieve fase
- Juridisch kader
-
Besluitvorming rondom diagnostiek en behandeling
- Structuur en proces
-
Meetinstrumenten
- Diagnostiek en behandeling van symptomen
- Rondom levenseinde
- Afscheid nemen, nazorg en rouw
-
Bijlagen
Pijn
Uitgangsvraag
Hoe dient pijn te worden vastgesteld en behandeld bij mensen met een verstandelijke beperking in de palliatieve fase?
Methode: evidence-based en consensus-based
Aanbevelingen
- Volg bij behandeling van pijn de richtlijnen Pijn bij patiënten met kanker en Pijn bij gevorderde stadia van COPD en hartfalen of voor huisartsen de NHG-standaard Pijn.
- Ga na welke pijnervaringen de cliënten in het verleden hebben gehad.
- Gebruik de PAINAD of de PACSLAC voor het monitoren van pijn bij mensen met verstandelijke beperking.
- Zorg voor voldoende scholing voor zorgverleners die pijn bij mensen met een verstandelijke beperking moeten kunnen monitoren.
- Documenteer hoe de cliënten gewoonlijk op pijn reageren en welke (farmacologische en non-farmacologische) interventies in het verleden hielpen. Vertrouw hierbij op informatie van zorgverleners en verwanten.
- Werk met een multidisciplinaire benadering en een behandelplan met als doel pijn te verminderen en het functioneren te optimaliseren.
- Betrek een arts VG als het met het bestaande behandelteam onvoldoende lukt om de mate van pijn of ongemak te duiden.
- Verwijs bij pijn samenhangend met houding, decubitus en/of ADL naar de ergotherapeut/fysiotherapeut VG voor advies voor zowel patiënt als ouders/verzorgers.
- Zorg voor goede voorlichting aan en begeleiding van alle betrokkenen.
- Wees alert op een verhoogd risico op sensibele regulaire stoornissen (slaap etc.).
- Cluster eventuele pijnlijke ingrepen zoveel als mogelijk en geef preventief pijnstilling, bijvoorbeeld lidocaïne/prilocaïnecrème voor injecties of venapuncties.
- Beoordeel frequent de aanwezigheid van pijn, evalueer de pijnbestrijding en pas zo nodig de dosering aan.
- Geef medicatie volgens een vast schema en niet ‘zo nodig', stem de dosering af op de pijnbeoordeling.
Inleiding
Pijn is meer dan een lichamelijke gewaarwording. Om de diverse aspecten van pijn te kunnen duiden, kan onder andere gebruik gemaakt worden van het model van Loeser (figuur 1). Dit model bestaat uit vier elkaar omvattende, steeds grotere cirkels die de vier niveaus van pijn weergeven. De kleinste cirkel is de weefselbeschadiging (nociceptieve component). Daaromheen ligt de tweede cirkel, de pijngewaarwording, datgene dat het centraal zenuwstelsel als somatische pijn waarneemt. De derde cirkel is de pijnbeleving: hoe men de pijn ervaart door beïnvloeding van de somatische pijn door psychische, sociale en spirituele factoren. Tenslotte de grootste cirkel, het pijngedrag. [Loeser 1999].
Bij mensen met een verstandelijke beperking is het van belang rekening te houden met beperking op het gebied van met name pijnbeleving en pijngedrag. Naarmate het begrip van het functioneren van het lichaam of het duiden van pijn moeizamer gaat, zal ook het adequaat uiten van die pijn bemoeilijkt worden. Pijngedrag kan dan zowel bestaan uit agressie naar anderen of automutilatie als zich terugtrekken, minder actief zijn, verminderde interesse in eten hebben [Zwakhalen 2004].
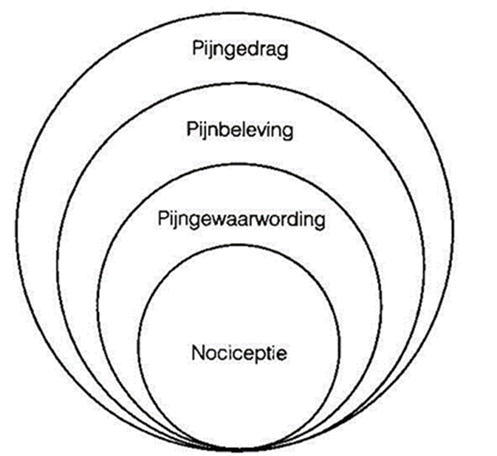
Figuur 1 Pijnmodel Loeser
Een ander begrip om tot goede diagnostiek en behandeling van pijn te komen is het begrip ‘total pain’/totale pijn van Saunders (figuur) waarbij net zoals in de benadering van palliatieve zorg de vier dimensies (somatische, psychische, sociale en spirituele dimensie) beschreven worden. Deze beïnvloeden elkaar en gezamenlijk de pijnervaring.
De somatische dimensie betreft de door de ziekte of de behandeling veroorzaakte pijn ten gevolge van weefselbeschadiging. Ook de mate van comfort in verschillende houdingen en bij verschillende bewegingen valt hieronder. Gebrek aan comfort kan pijn veroorzaken.
De psychische dimensie heeft betrekking op affectieve en cognitieve kenmerken van cliënten. Bij mensen met een verstandelijke beperking dient hierbij ook het ontwikkelingsniveau zowel cognitief als sociaal-emotioneel meegenomen te worden. Depressie en rouw behoren tot de psychische dimensie, evenals emoties zoals angst, verdriet, boosheid, schuldgevoelens, schaamte, spanning, (onvoldoende) acceptatie van de ziekte, wanhoop en eenzaamheid. Ook het gevoel niet serieus genomen te worden door hulpverleners kan zeker bij mensen met een lichte verstandelijke beperking of zwakbegaafdheid een belangrijke psychische factor zijn. De vaak in zorgplannen beschreven levens- en ervaringsgeschiedenis van cliënten is belangrijk voor het begrijpen van de psychische dimensie. Zo kunnen eerdere negatieve ervaringen van cliënten met andere mensen met pijn of een ongeneeslijke ziekte veel angst veroorzaken. De sociale dimensie heeft betrekking op de relatie van cliënten tot hun omgeving en de invloed daarvan op de pijn. Het betreft bijvoorbeeld culturele aspecten, financiële problemen, arbeids-dagbestedingsgerelateerde problemen, conflicten, zorgen om naasten en de reactie van naasten op de ziekte of op de pijn. Denk hierbij ook aan het vaak afhankelijk zijn van verzorging.
De spirituele dimensie betreft zingeving en levensbeschouwing, bijvoorbeeld in het kader van religie, van (verlies of verandering van) identiteit, (verlies van) hoop, existentiële angst, confrontatie met sterfelijkheid of verandering van de betekenis van het bestaan. De dood is als abstract begrip voor mensen met een verstandelijke beperking vaak moeilijk te begrijpen. Zo kan hun ervaring dat medecliënten naar het ziekenhuis gingen en nooit meer terugkeerden, bijdragen aan angst voor het ziekenhuis en dit associëren met de dood, waardoor pijn gecamoufleerd wordt. Het samenspel van de vier dimensies bepaalt de pijnbeleving en het pijngedrag.
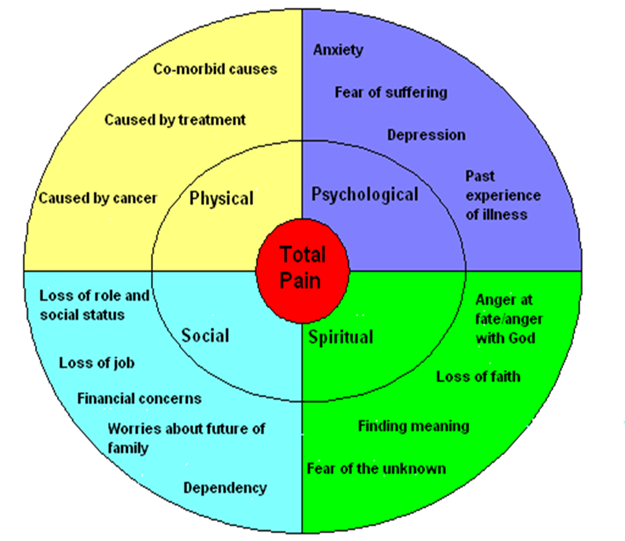
Figuur2 ‘Total pain’ model Saunders
In de zorg voor mensen met een verstandelijke beperking wordt vaak al gewerkt vanuit deze holistische benadering.
Diagnostiek
Cliënten in de palliatieve fase kampen met lichamelijke en psychische klachten. Een van de problemen waar palliatieve cliënten vaak te maken hebben is pijn. Zéker cliënten met een verstandelijke beperking hebben veel moeite om pijnklachten te uiten en aan te geven in welke mate deze klachten hen beperken. Hoewel de naasten de cliënten vaak heel goed kennen en de signalen van hun dierbaren soms beter kunnen interpreteren dan zorgverleners die de cliënten minder goed kennen, is het ook voor hen vaak moeilijk om te bepalen of klachten bestaan en in welke mate deze beperkend zijn. Veel zorgverleners in de gehandicaptenzorg hebben een niet-medische opleiding gevolgd (SPW, SPH) [Agora 2017]. De kennis en kunde van begeleiders in de gehandicaptenzorg is voornamelijk gericht op pedagogiek en gedrag. Vanuit deze kennis signaleren begeleiders vaak gedragsverandering als een van de eersten, maar hebben vanwege hun beperkte medische kennis moeite dit gedrag aan somatiek te koppelen. Ze herkennen ongeneeslijke ziekten vaak niet en zijn niet of beperkt op de hoogte van de specifieke aanpak die daarbij hoort, zoals het gebruik van bestaande richtlijnen en signaleringshulpmiddelen (onbewust onbekwaam). Begeleiders weten vaak niet wat te doen met een niet-pluisgevoel over cliënten. Er is handelingsverlegenheid. Klachten van cliënten worden hierdoor vaak laat of niet ontdekt. Om pijn bij cliënten met (en zonder) verstandelijke beperking vroeger te kunnen herkennen en behandelen zijn hulpmiddelen als meetinstrumenten onmisbaar.
Meetinstrumenten
In 2017 werd het Kwaliteitskader palliatieve zorg Nederland gelanceerd. Bij dit Kwaliteitskader hoort een addendum ‘Meetinstrumenten in de palliatieve zorg’. In dit addendum heeft de werkgroep in consensus de volgende definitie voor de omschrijving van meetinstrumenten gebruikt: ‘Meetinstrumenten in de palliatieve zorg zijn gestructureerd vormgegeven hulpmiddelen, gebaseerd op uitkomsten van wetenschappelijk onderzoek, die zowel patiënt als zorgverlener helpen inzicht te geven in de problematiek van de patiënt en/of diens naasten, ter ondersteuning van de besluitvorming rond de inzet van interventies (dan wel het nalaten daarvan) en de evaluatie van de uitkomsten.’
In het addendum is het ‘trechtermodel’ gebruikt. De trechter bevat vier meetniveaus, namelijk signaleren, monitoren, verdiepen en diagnosticeren. Dit betekent dat eerst een symptoom wordt gesignaleerd en pas als het aanwezig is, het wordt het gemonitord en/of uitgediept en eventueel diagnosticeert.
De literatuurzoektocht identificeerde zes systematische reviews:
- Coca et al. zochten naar meetinstrumenten voor de evaluatie van pijn bij niet-communicatieve (oudere) cliënten [Coca 2020]. Ze includeerden 10 studies (gepubliceerd tussen 2012 en 2018) die zeven pijninstrumenten evalueerden. Er werden echter geen numerieke gegevens gerapporteerd en deze review wordt daarom verder buiten beschouwing gelaten.
- Corbett et al. zochten naar meetinstrumenten voor de evaluatie van pijn bij dementerende cliënten [Corbett 2014]. Ze includeerden 11 studies (gepubliceerd tot september 2012) die 12 pijninstrumenten evalueerden. Ook hier werden geen numerieke gegevens gerapporteerd en deze review wordt daarom ook verder buiten beschouwing gelaten. Deze review werd uitgevoerd als voorbereiding op de ontwikkeling van het PAIC15-instrument.
- Ellis-Smith et al. zochten ruim naar meetinstrumenten die veel voorkomende symptomen evalueren bij cliënten met dementie in een chronische zorgsetting [Ellis-Smith 2016]. Ze includeerden 40 studies (gepubliceerd tot juni 2015) die 32 meetinstrumenten evalueerden, waarvan 12 pijninstrumenten.
- Lichtner et al. zochten naar meetinstrumenten die pijn evalueren bij cliënten met dementie in een acute zorgsetting [Lichtner 2014]. Ze includeerden 23 systematische reviews (gepubliceerd tot maart 2013) die 28 pijninstrumenten evalueerden.
- Rostad et al. zochten naar studies die het Doloplus-2 instrument evalueerden bij 65-plussers met dementie of cognitieve beperking [Rostad 2017]. Ze includeerden 24 studies (gepubliceerd tussen 1990 en april 2017).
- Siok et al. zochten naar meetinstrumenten die pijn evalueren op basis van gedrag en observatie bij ouderen met dementie of lagere score op MMSE [Siok 2012]. Ze includeerden 23 studies (gepubliceerd tussen 1990 en 2010) die 10 pijninstrumenten evalueerden.
Aanvullend werden twee gerandomiseerde studies gevonden:
- In een cluster-gerandomiseerde studie randomiseerden Fry et al. 602 cliënten (65+) met een verstandelijke beperking en een acute botfractuur naar pijnevaluatie met het PAINAD-instrument (N=323) of volgens de standaardzorg (N=279) [Fry 2018].
- Lukas et al. randomiseerden in een cross-over trial 45 cliënten met alzheimerdementie of vasculaire dementie en vermoeden van pijn naar behandeling met oxycodone of placebo (Lukas 2019). Pijn werd beoordeeld met de Duitse versie van het PAINAD-instrument, het BISAD-instrument (Observation Instrument for Assessing Pain in Elderly With Dementia), het CNPI-instrument en het Algoplus-instrument.
Bovendien werden nog 20 observationele studies gevonden die niet in één van de zeven reviews werden geïncludeerd:
- Ammaturo et al. toonden geacteerde pijnvideo’s van een dementerende oudere aan 65 leken en 65 zorgkundigen en evalueerden hiermee de psychometrische eigenschappen van het PACSLAC-II en het PAINAD-instrument [Ammaturo 2017].
- Atee et al. includeerden 37 dementerende ouderen (65+) met pijnlijke aandoeningen die in een woonzorgcentrum verbleven [Atee 2017a]. Pijn werd geëvalueerd met de Electronic Pain Assessment Tool (ePAT) en de Abbey Pain Scale (APS) door twee onafhankelijke beoordelaars.
- In een tweede studie includeerden Atee et al. 40 dementerende bewoners (60+) van een woonzorgcentrum met chronische pijn (Atee 2017b). Ook in deze studie werd pijn geëvalueerd met de Electronic Pain Assessment Tool (ePAT) en de Abbey Pain Scale (APS) door twee onafhankelijke beoordelaars.
- In een derde studie includeerden Atee et al. 10 dementerende bewoners van een woonzorgcentrum met pijnlijke aandoeningen [Atee 2018]. Pijn werd geëvalueerd met de Electronic Pain Assessment Tool (ePAT).
- Bonin-Guillaume et al. includeerden 176 cliënten (65+) in verschillende geriatrische settings [Bonin-Guillaume 2016]. Evaluatie van pijn gebeurde voor verschillende subgroepen (met/zonder pijn, met/zonder dementie, met/zonder depressie) met een numerieke ratingschaal (NRS), het Algoplus-instrument, het Doloplus-instrument en/of het PACSLAC-instrument. Voor dit laatste instrument werden echter geen aparte resultaten voor cliënten met dementie gerapporteerd.
- Chan et al. reviseerden het PACSLAC-instrument op basis van klinische en theoretische literatuur [Chan 2014]. Het resulterende PACSLAC-II instrument werd gevalideerd via pijnvideo’s van 124 dementerende bewoners van een woonzorgcentrum die getoond werden aan 26 zorgverleners.
- Erin Browne et al. toonden pijnvideo’s van 102 volwassen (65+) met en zonder dementie aan getrainde en niet-getrainde beoordelaars en evalueerden hiermee de psychometrische eigenschappen van het PACSLAC-II instrument en het Facial Action Coding System (FACS) [Erin Browne 2019]. Aparte cijfers voor cliënten met dementie werden niet gerapporteerd.
- Ersek et al. includeerden 190 dementerende bewoners (50+) van woonzorgcentra [Ersek 2019]. Pijn werd geëvalueerd met het PIMD-instrument en het MOBID-instrument.
- Haghi et al. includeerden 138 dementerende bewoners (60+) van twee verpleeghuizen [Haghi 2019]. Alle cliënten hadden gedurende minstens 3 maanden een pijnlijke aandoening. Pijn werd geëvalueerd met de Iraanse versie van het PACSLAC-II instrument.
- Husebo et al. evalueerden de psychometrische eigenschappen van het MOBID-2 instrument op basis van gegevens van een gerandomiseerde studie die 352 dementerende bewoners van 18 Noorse verpleeghuizen includeerde [Husebo 2014].
- Jordan et al. includeerden 79 dementerende bewoners van 4 verpleeghuizen [Jordan 2011]. Pijn werd geëvalueerd met het PAINAD-instrument.
- Likar et al. includeerden 127 oudere cliënten (65+) met een verstandelijke beperking [Likar 2015]. Pijn werd beoordeeld met de Duitse versie van het Doloshort-instrument.
- Lukas et al. includeerden 178 cliënten (65+) met multimorbiditeit en indicaties van pijn en/of behandeling met pijnstillers [Lukas 2013]. Pijn werd geëvalueerd met het PAINAD-instrument (Duitse versie). Aparte cijfers voor cliënten met dementie werden niet gerapporteerd (40% had verstandelijke beperking).
- McGuire et al. analyseerden de psychometrische eigenschappen van het MOPAT-instrument op basis van de gegevens van 58 cliënten met pijn [McGuire 2011]. 52% van deze cliënten had verstandelijke beperking, maar aparte cijfers werden niet gerapporteerd.
- Meir et al. onderzochten of de Non-Communicating Adults Pain Checklist (NCAPC) als pijnmodel voor volwassenen met een verstandelijke beperking en ontwikkelingsstoornissen (IDD) kan worden ingezet [Meir 2012]. Dit werd onderzocht met video-opnamen van 228 deelnemers (gemiddelde leeftijd: 38,7 jaar) voor en tijdens een griepvaccinatie. Het pijnmodel is geconstrueerd met behulp van eerder verzamelde gegevens door middel van bevestigende factoranalyse van de somscores, met behulp van de halfsplit-procedure. Het model werd getest op een gerandomiseerde groep deelnemers (N=89) voor generalisatie.
- Mosele et al. includeerden 600 consecutieve oudere cliënten met verschillende niveaus van verstandelijke beperking [Mosele 2012]. Pijn werd beoordeeld met de Italiaanse versie van het PAINAD-instrument.
- Sheu et al. toonden pijnvideo’s van 30 oudere cliënten met heup- of rugpijn aan vijf getrainde beoordelaars [Sheu 2011]. De pijnvideo’s werden gecodeerd met het FACS-systeem en ingedeeld in drie categorieën (milde, matige of ernstige pijn). Evaluatie van de pijn gebeurde met de gelaatsuitdrukking subschalen van de volgende zes instrumenten: Doloplus-2, Mahoney Pain Scale, Abbey Pain Scale, NOPPAIN, PACSLAC en PAINAD. Aparte cijfers voor cliënten met dementie werden niet gerapporteerd.
- Shinde et al. includeerden 44 volwassen cliënten (46,5) met een matig tot ernstig verstandelijke beperking [Shinde, 2014]. Hiervan konden 36 personen niet spreken. Het doel van de studie was om eerste convergentie van de Pain and Discomfort Scale (PADS) te onderzoeken. Met behulp van een gestandaardiseerd placebo en geblindeerd sensorisch testprotocol, werden de Facial Action Coding System (FACS)- en PADS-scores onderzocht op gevoeligheid voor een reeks van gekalibreerde sensorische stimuli, specificiteit (actieve versus schijnproeven) en concordantie. FACS is een objectief coderingsplatform voor gezichtsuitdrukking.
- The et al. includeerden 50 dementerende bewoners (60+) van een verpleeghuis, blootgesteld aan verschillende pijnlijke situaties [The 2016]. Pijn werd geëvalueerd met de Braziliaanse versie van het PACSLAC-instrument.
- Ware et al. includeerden 75 cliënten (65+) met of zonder verstandelijke beperking en met of zonder pijn [Ware 2015]. Pijn werd geëvalueerd met de herziene versie van de Iowa Pain Thermometer.
- Zhou et al. includeerden 200 cliënten (20+) die een chirurgische ingreep hadden ondergaan en waarvan de 60-plussers hooguit lichte verstandelijke beperking hadden [Zhou 2011]. Pijn werd geëvalueerd met de volgende instrumenten: numerieke rating schaal, de Verbal Descriptor Scale (VDS), de Faces Pain Scale (FPS), de Numeric Box-21 Scale (BS-21) en de Colored Analogue Scale (CAS).
- Zwakhalen et al. includeerden 61 dementerende bewoners van een verpleeghuis [Zwakhalen 2012]. Pijn werd geëvalueerd met (de Nederlandse versie van) de PAINAD-schaal. Op basis van een literatuurnazicht en een secundaire analyse van een eerdere studie werd een ideale afkapwaarde bepaald. Voor deze waarde werden de sensitiviteit en specificiteit berekend.
Twee studies bespraken de ontwikkeling van het PAIC15-instrument [Kunz 2020, Van Dalen-Kok 2018]. Gezien geen van deze studies het uiteindelijke instrument valideerden, worden deze studies ook niet verder besproken.
Tenslotte werden twee studies geïncludeerd die een pediatrische populatie betroffen (hoewel het literatuurnazicht hier niet op gericht was). Crosta et al. zochten naar meetinstrumenten die pijn evalueren bij kinderen met een verstandelijke beperking in een acute zorgsituatie die hun pijn niet zelf kunnen rapporteren [Crosta 2014]. Ze includeerden 7 studies (gepubliceerd tussen 1994 en 2012) die 4 pijninstrumenten evalueerden. Massaro et al. includeerden 40 kinderen met een onvermogen tot verbale communicatie wegens verstandelijke beperking [Massaro 2014]. Pijn werd geëvalueerd met de NCCPC-PV schaal (Non-Communicating Child's Pain Checklist – Postoperative Version), de DESS-schaal (Echelle Douleur Enfant San Salvador) en de CHEOPS-schaal (Children's Hospital of Eastern Ontario Pain Scale).
(NB: De literatuurzoektocht identificeerde ook 8 studies [Chen 2010, Chen 2015, Ersek 2010, Husebo 2010, Kaasalainen 2013, Lints-Martindale 2012, Liu 2010, Neville 2014] die reeds geïncludeerd werden in minstens één van de systematische reviews; deze studies worden niet apart beschreven.)
Kwaliteit van het bewijs
De reviews van Lichtner et al, Rostad et al. en Siok et al. waren van goede kwaliteit [Lichtner 2014, Rostad 2017, Siok 2012]. Er werd gezocht in meerdere databases (Rostad et al. weliswaar slechts in drie databases), het reviewproces gebeurde door minstens twee onafhankelijke reviewers. Van twee reviews was het onduidelijk of het reviewproces door onafhankelijke reviewers gebeurde [Corbett 2014, Crosta 2014]. In de overige twee reviews gebeurde het reviewproces minstens deels door onafhankelijke reviewers [Coca 2020, Ellis-Smith 2016]. Vier reviews beperkten zich tot Engelstalige literatuur [Lichtner 2014, Siok 2012, Ellis-Smith 2016, Crosta 2014]. In één review was de taalrestrictie onduidelijk, twee andere reviews beperkten zich tot Engels en minstens één andere taal.
De twee gerandomiseerde studies hadden een hoog risico op bias. In één studie was er geen blindering van de cliënten en behandelaars en waren de basiskarakteristieken van beide behandelgroepen statistisch significant verschillend [Fry 2018] In de andere (cross-over) studie was er geen wash-out periode, hetgeen potentieel bias introduceerde voor de beoordeling van het analgetische effect [Lukas 2019].
Van de overige 23 studies waren er slechts vijf expliciet prospectief [Atee 2017a, Atee 2017b, Lukas 2013, Meir 2012, Mosele 2012]. Slechts één studie includeerde consecutieve cliënten [Mosele 2012] Twee studies baseerden zich op gegevens van een gerandomiseerde studie of voerden deze uit [Husebo 2014, Meir 2012]. In zo goed als alle studies was er onduidelijke selectiebias.
(1) Abbey Pain Scale (APS)
Interbeoordelaarsbetrouwbaarheid
Siok et al. vonden één studie bij dementerende ouderen met een matige interbeoordelaarsbetrouwbaarheid rapporteerde, maar numerieke gegevens werden niet gerapporteerd (Siok 2012). Een andere studie bij dementerende cliënten rapporteerde een hoge interbeoordelaarsbetrouwbaarheid voor de Japanse versie van de APS-schaal (intraclass coëfficiënt=0,845) [Siok 2012]. Lichtner et al. rapporteerden een intraclass coëfficiënt tussen 0,44 en 0,845 [Lichtner 2014].
Sheu et al. rapporteerden voor de gelaatsuitdrukkingcomponent een Cohens kappa van -,20 tot 0,42 voor milde pijn, -0,10 tot 0,52 voor matige pijn en 0,11 tot 0,48 voor ernstige pijn [Sheu 2011].
Test-hertest betrouwbaarheid
Siok et al. vonden één studie bij dementerende cliënten die een goede test-hertestbetrouwbaarheid rapporteerde voor de Japanse versie van de APS-schaal (intra-class coëfficiënt=0,657) [Siok 2012, Lichtner 2014].
Interne consistentie
Siok et al. vonden één studie bij dementerende ouderen die een goede interne consistentie rapporteerde (Cronbachs alfa=0,74) [Siok 2012]. Een tweede studie bij dementerende cliënten rapporteerde een lagere interne consistentie voor de Japanse versie van de APS-schaal (Cronbachs alfa=0,645) [Siok 2012]. Lichtner et al. rapporteerden een Cronbachs alfa tussen 0,645 en 0,81 [Lichtner 2014].
Concurrente en convergente validiteit
Siok et al. vonden één studie bij dementerende ouderen die een matige correlatie rapporteerde tussen de totale APS-score en een holistische pijnscore bepaald door verpleegkundigen (gamma=0,586, p<0,001) [Siok 2012]. Een tweede studie vond eveneens een matige correlatie tussen de totale APS-score enerzijds en de Verbal Descriptor Scale-score (rs=0,492, p<0,01) en zelfrapportering (p<0,001) anderzijds [Siok 2012]. Dit was echter niet het geval voor twee subschalen (‘change in body language’ en ‘physiological change’).
Atee et al. vonden een goede correlatie tussen het ePAT-instrument en de APS-schaal (Pearsons r: totaal 0,911; rust 0,896; beweging 0,904) [Atee 2017a]. De correlatie was niet situatie-afhankelijk (p=0,243). Ook in een tweede studie vonden Atee et al. een goede correlatie tussen het ePAT-instrument en de APS-schaal (Pearsons r: totaal 0,822; rust 0,880; beweging 0,894) [Atee 2017b]. Ook hier was de correlatie niet situatie-afhankelijk (p=0,795).
Sheu et al. rapporteerden voor de correlatie tussen de gelaatsuitdrukkingcomponent en het FACS-systeem een Pearsons r van 0,259 voor milde pijn, 0,674 voor matige pijn en 0,631 voor ernstige pijn [Sheu 2011].
Discriminerende validiteit
Siok et al. vonden één studie bij dementerende ouderen die een statistisch significante reductie in gemiddelde pijnscore rapporteerde na pijnbehandeling (pre 9,02 vs. post 4,21; p<0,001) [Siok 2012].
Atee et al. vonden statistisch significant hogere gemiddelde pijnscores na beweging dan in rust (6,96 vs. 4,34; p<0,0001) [Atee 2017a].
(2) Checklist of Nonverbal Pain Indicators (CNPI)
Interbeoordelaarsbetrouwbaarheid
Siok et al. vonden drie studies (met hoofdzakelijk cliënten met dementie) met uiteenlopende graden van interbeoordelaarsbetrouwbaarheid voor het CNPI-instrument [Siok 2012]. Eén studie vond een Cohens kappa van 0,625 tot 0,819. Een tweede studie vond een lagere interbeoordelaarsbetrouwbaarheid, zowel in rust (Cohens kappa=0,43) als bij beweging (0,25). De derde studie vond een matige interbeoordelaarsbetrouwbaarheid (Cohens kappa=0,45-0,69). Lichtner et al. vonden geen aanvullende informatie [Lichtner 2014].
Test-hertestbetrouwbaarheid
Siok et al. vonden één studie die een matige test-hertestbetrouwbaarheid rapporteerde (Cohens kappa=0,23-0,66) [Siok 2012].
Interne consistentie
Siok et al. vonden één studie die een lage interne consistentie rapporteerde in rust (Cronbachs alfa=0,54) en bij beweging (Cronbachs alfa=0,64) [Siok 2012]. In een tweede studie werd een betere interne consistentie gevonden, zowel in rust (Cronbachs alfa=0,92-0,97) als bij beweging (Cronbachs alfa=0,74-0,90) [Siok 2012].
Concurrente en convergente validiteit
Siok et al. vonden één studie die een statistisch significante correlatie rapporteerde tussen het CNPI-instrument en de VDS-schaal in rust (Spearman correlatie coëfficiënt=0,372) en bij beweging (Spearman correlatie coëfficiënt=0,428) [Siok 2012]. Specifiek voor de populatie met een verstandelijke beperking was er enkel een statistisch significante correlatie bij beweging (Spearman correlatie coëfficiënt=0,463) [Siok 2012]. Een tweede studie rapporteerde een statistisch significante correlatie met een VAS-beoordeling door verpleegkundigen (Spearman correlatie coëfficiënt=0,69-0,88) [Siok 2012].
Lukas et al. vonden tijdens beweging matige tot goede correlaties met de Duitse versie van het PAINAD-instrument (Spearman correlatie coëfficiënt=0,621-0,749), het BISAD-instrument (Spearman correlatie coëfficiënt=0,507-0,682) en het Algoplus-instrument (Spearman correlatie coëfficiënt=0,583-0,784) [Lukas 2019].
Discriminerende validiteit
Siok et al. vonden één studie die hogere CNPI-scores rapporteerde tijdens beweging dan in rust (gemiddeld: 1,56 vs. 0,89) [Siok 2012].
(3) Certified Nursing Assistant Pain Assessment Tool (CPAT)
Siok et al. en Lichtner et al. vonden één studie bij dementerende cliënten die een goede interbeoordelaarsbetrouwbaarheid (ICC=0,71) en test-hertestbetrouwbaarheid (ICC=0,67) rapporteerde voor de Certified Nursing Assistant Pain Assessment Tool (CPAT) [Siok 2012, Lichtner 2014]. Diezelfde studie rapporteerde een statistisch significant verschil in CPAT-scores voor en na een pijnlijk event (gemiddeld verschil=0,33; p=0,043) [Siok 2012].
(4) Doloplus-2
Interbeoordelaarsbetrouwbaarheid
Rostad et al. vonden 8 studies die de interbeoordelaarsbetrouwbaarheid rapporteerden [Rostad 2017]. Cohens kappa varieerde tussen 0,31 en 0,69 (één studie). De Spearman correlatie r bedroeg 0,90 in een studie. De intra-class coëfficiënt (ICC) varieerde tussen 0,73 en 0,97 (vijf studies; ICC=0,75 voor de Nederlandse versie), de gewogen kappa varieerde tussen 0,19 en 1,0 (2 studies) al naargelang de taal. De reviews van Siok et al. [Siok 2012] en Lichtner et al. [Lichtner 2014] gaven geen bijkomende informatie.
Test-hertestbetrouwbaarheid
Rostad et al. vonden 3 studies die de test-hertest betrouwbaarheid rapporteerden [Rostad 2017]. Pearsons r bedroeg 0,71 in een studie en varieerde tussen 0,57 en 0,99 in een tweede studie al naargelang de taal. De intra-class coëfficiënt bedroeg 0,96 in de derde studie en varieerde in de tweede studie tussen 0,62 (Nederlandse versie) en 0,98 (Italiaanse versie) al naargelang de taal. De reviews van Siok et al. [Siok 2012] en Lichtner et al. [Lichtner 2014] gaven geen bijkomende informatie.
Interne consistentie
Rostad et al. vonden zeven studies die de interne consistentie rapporteerden [Rostad 2017]. Cronbachs alfa varieerde tussen 0,67 en 0,87 (0,75 voor de Nederlandse versie). De reviews van Siok et al. [Siok 2012] en Lichtner et al. [Lichtner 2014] gaven geen bijkomende informatie.
Concurrente en convergente validiteit
Siok et al. [Siok 2012] en Lichtner et al. [Lichtner 2014] vonden een lage correlatie wanneer het Doloplus-2 instrument vergeleken werd met het PAINAD-instrument (r=0,34) of met het PACSLAC-instrument (r=0,29-0,38). In vergelijking met zelfrapportering was er een betere correlatie (r=0,31-0,65) [Lichtner 2014].
Bonin-Guillaume et al. vonden een goede correlatie met het Algoplus-instrument (dementie: Spearman correlatie coëfficiënt=0,87; dementie en depressie: Spearman correlatie coëfficiënt=0,86) [Bonin-Guillaume 2016].
Sheu et al. rapporteerden voor de correlatie tussen de gelaatsuitdrukkingcomponent en het FACS-systeem een Pearsons r van -0,134 voor milde pijn, 0,161 voor matige pijn en 0,099 voor ernstige pijn [Sheu 2011].
Discriminerende validiteit
Rostad et al. vonden vier studies die de predictieve validiteit rapporteerden [Rostad 2017]. Eén studie rapporteerde een statistisch significante reductie in de gemiddelde totaalscore na een jaar van maandelijkse beoordelingen. De drie andere studies rapporteerden statistisch significante reducties in de totaalscore (3 studies) en subschalen (1 studie) na pijnbehandeling. Numerieke gegevens werden echter niet gerapporteerd. De reviews van Siok et al. [Siok 2012] en Lichtner et al. [Lichtner 2014] gaven geen bijkomende informatie.
(5) Mahoney Pain Scale (MPS)
Interbeoordelaarsbetrouwbaarheid
Siok et al. vonden één studie met cliënten met gevorderde dementie die Cohens kappa van 0,43 tot 0,77 rapporteerden voor een aangename activiteit en van 0,55 tot 0,85 voor een onaangename activiteit [Siok 2012]. Lichtner et al. [Lichtner 2014] gaven geen bijkomende informatie.
Sheu et al. rapporteerden voor de gelaatsuitdrukkingcomponent een Cohens kappa van 0,08 tot 0,46 voor milde pijn, 0,06 tot 0,56 voor matige pijn en 0,12 tot 0,59 voor ernstige pijn [Sheu 2011].
Interne consistentie
Siok et al. vonden één studie die een Cronbachs alfa van 0,76 rapporteerde [Siok 2012].
Concurrente en convergente validiteit
Siok et al. vonden één studie die een goede overeenkomst rapporteerde tussen de MPS-scores en pijnbeoordelingen door verpleegkundig assistenten wat de aanwezigheid van pijn betreft (Cohens kappa=0,86) en een matige overeenkomst wat de pijnernst betreft (Cohens kappa=0,54) [Siok 2012].
Sheu et al. rapporteerden voor de correlatie tussen de gelaatsuitdrukkingcomponent en het FACS-systeem een Pearsons r van 0,45 voor milde pijn, 0,68 voor matige pijn en 0,59 voor ernstige pijn [Sheu 2011].
Discriminerende validiteit
Siok et al. vonden één studie die een area under the curve rapporteerde van 0,95 (p<0,001) [Siok 2012]. De afkapwaarde om pijn vast te stellen bedroeg 4,5 (sensitiviteit 100%, specificiteit 93%).
(6) Mobilization-Observation-Behavior-Intensity-Dementia Pain Scale (MOBID/MOBID-2)
Interbeoordelaarsbetrouwbaarheid
Siok et al. rapporteerden een goede interbeoordelaarsbetrouwbaarheid voor het MOBID-instrument (1 studie; ICC=0,86) [Siok 2012]. Voor het MOBID-2 instrument werd een betere interbeoordelaarsbetrouwbaarheid gerapporteerd voor het eerste deel van het instrument (één studie; Cohens kappa=0,44-0,90; ICC=0,90-0,94), maar niet voor het tweede deel (1 studie; Cohens kappa=0,46-0,80; ICC=0,80-0,84). De review van Lichtner et al. [Lichtner 2014] gaf geen bijkomende informatie.
Test-hertest betrouwbaarheid
Siok et al. vonden één studie die een Cohens kappa rapporteerde van 0,41 tot 0,83 en een ICC van 0,60 tot 0,92 voor het eerste deel van het MOBID-2 instrument en Cohens kappa van 0,48 tot 0,93 en een ICC van 0,61 tot 0,94 voor het tweede deel [Siok 2012]. De review van Lichtner et al. [Lichtner 2014] gaf geen bijkomende informatie.
Husebo et al. rapporteerden een ICC van 0,729 tot 0,889 voor de individuele onderdelen van het MOBID-2 instrument en een ICC van 0,805 tot 0,852 voor de totaalscore [Husebo 2014].
Interne consistentie
Siok et al. rapporteerden een goede interne consistentie van het MOBID-instrument (één studie; Cronbachs alfa=0,90-0,91) [Siok 2012]. Voor het MOBID-2 instrument was de interne consistentie lager (een studie; Cronbachs alfa=0,82-0,84). De review van Lichtner et al. [Lichtner 2014] gaf geen bijkomende informatie.
Concurrente en convergente validiteit
Ersek et al. vonden een goede correlatie met de PIMD-schaal (Pearsons r=0,59) bij beweging, maar niet in rust (Pearsons r=0,24) [Ersek 2019].
Discriminerende validiteit
Husebo et al. vonden een statistisch significante verbetering in pijn gemeten met het MOBID-2 instrument in de groep behandeld met een stapsgewijze pijnbehandeling versus de groep behandeld met gewone zorg (gemiddelde verbetering: 1,7 vs. 0,3; p<0,001) [Husebo 2014].
(7) Nursing Assistant-Administered Pain Assessment Instrument for Use in Dementia (NOPPAIN)
Interbeoordelaarsbetrouwbaarheid
Siok et al. vonden één studie die Cohens kappa van 0,72 tot 1,00 en een ICC van 0,72 tot 1,00 rapporteerde [Siok 2012]. Lichtner et al. rapporteerden Cohens kappa van 0,70 tot 0,87 [Lichtner 2014]. De kappa van 0,73 gerapporteerd door Ellis-Smith et al. valt eveneens in deze range [Ellis-Smith 2016].
Sheu et al. rapporteerden voor de gelaatsuitdrukkingcomponent een Cohens kappa van 0,23 voor ernstige pijn [Sheu 2011].
Test-hertestbetrouwbaarheid
Siok et al. vonden één studie die Cohens kappa van 0,70 tot 0,86 en een ICC van 0,69 tot 0,95 rapporteerde [Siok 2012].
Concurrente en convergente validiteit
Sheu et al. rapporteerden voor de correlatie tussen de gelaatsuitdrukkingscomponent en het FACS-systeem een Pearsons r van 0,346 voor milde pijn, 0,700 voor matige pijn en 0,592 voor ernstige pijn [Sheu 2011].
Ellis-Smith et al. rapporteerden een hoge correlatie (r≤0,70) met de CNPI-, PACSLAC-, PADE- en PAINAD-instrumenten [Ellis-Smith 2016].
(8) Pain Assessment Checklist for Seniors with Limited Ability to Communicate (PACSLAC)
Interbeoordelaarsbetrouwbaarheid
Siok et al. vonden één studie die een ICC van 0,93 tot 0,96 rapporteerde voor de Nederlandse versie van het PACSLAC-instrument [Siok 2012]. Lichtner et al. rapporteerden een ICC van 0,77 tot 0,96 [Lichtner 2014]. Ellis-Smith et al. gaven geen bijkomende informatie [Ellis-Smith 2016].
Ammaturo et al. rapporteerden een ICC van 0,94 voor het PACSLAC-II instrument (Ammaturo 2017). Erin Browne et al. vonden Cohens kappa van 0,66 tot 0,92 voor het PACSLAC-II instrument [Erin Browne 2019]. Haghi et al. vonden een ICC van 0,76 voor de Iranese versie van het PACSLAC-II instrument [Haghi 2019]. The et al. rapporteerden een ICC van 0,852 en een Cohens kappa van 0,381 voor de Braziliaanse versie van het PACSLAC-instrument [The 2016].
Sheu et al. rapporteerden voor de gelaatsuitdrukkingcomponent een Cohens kappa van 0,02 voor ernstige pijn (Sheu 2011).
Test-hertestbetrouwbaarheid
Siok et al. vonden één studie die een ICC van 0,86 rapporteerde voor de Nederlandse versie van het PACSLAC-instrument [Siok 2012].
The et al. rapporteerden een ICC van 0,643 en Cohens kappa van 0,215 voor de Braziliaanse versie van het PACSLAC-instrument [The 2016].
Interne consistentie
Siok et al. vonden één studie die een Cronbachs alfa van 0,82 tot 0,87 rapporteerde [Siok 2012].
Ammaturo et al. evalueerden de interne consistentie van het PACSLAC-II instrument op twee manieren [Ammaturo 2017]. Cronbachs alfa bedroeg 0,69, de Spearman-Brown coëfficiënt 0,72.
Chan et al. vonden voor het PACSLAC-II instrument een Cronbachs alfa van 0,77 na griepvaccinatie en 0,74 na beweging [Chan 2014]. Cohens kappa bedroeg 0,63. Haghi et al. rapporteerden een Cronbachs alfa tussen 0,72 en 0,84 voor de drie subschalen van de Iranese versie van het PACSLAC-II instrument [Haghi 2019]. The et al. rapporteerden Cronbachs alfa van 0,827 voor de Braziliaanse versie van het PACSLAC-instrument [The 2016].
Concurrente en convergente validiteit
Siok et al. vonden één studie die een matige tot goede correlatie rapporteerde tussen het PACSLAC-instrument en globale pijnbeoordelingen (Pearsons r=0,39-0,54) [Siok 2012]. Een tweede studie vond een sterke correlatie tussen de Nederlandse versie van het PACSLAC-instrument en een VAS-beoordeling (Pearsons r=0,72-0,80) [Siok 2012]. Ook een sterke correlatie met het PAINAD-instrument werd gevonden (Pearsons r=0,85).
Ammaturo et al. vonden een positieve correlatie tussen de meeste scores met het PACSLAC-II instrument en het PAINAD instrument voor de 7 getoonde pijnvideo’s, zowel voor leken (Pearsons r=0,12 tot 0,60) als voor zorgkundigen (Pearsons r=0,24 tot 0,40) [Ammaturo 2017].
Chan et al. vonden goede correlaties tussen het PACSLAC-II instrument en het PACSLAC-instrument (Pearsons r=0,66-0,89), het CNPI-instrument (Pearsons r=0,56-0,78), het NOPPAIN-instrument (Pearsons r=0,73-0,82), het PADE-instrument (Pearsons r=0,65-0,80) en het PAINAD-instrument (Pearsons r=0,68-0,86) [Chan 2014].
Haghi et al. rapporteerden een behoorlijke correlatie van de Iranese versie van het PACSLAC-II instrument met de Brief Pain Inventory (Spearman’s rank order correlatie=0,43) [Haghi 2019]
Sheu et al. rapporteerden voor de correlatie tussen de gelaatsuitdrukkingcomponent en het FACS-systeem een Pearsons r van 0,094 voor milde pijn, 0,755 voor matige pijn en 0,647 voor ernstige pijn [Sheu 2011].
Discriminerende validiteit
Siok et al. vonden één studie die hogere scores rapporteerde met de Nederlandse versie van het PACSLAC-instrument voor pijnlijke dan voor niet-pijnlijke gebeurtenissen (gemiddelde score: 5,5 vs. 2,6) [Siok 2012].
(9) Pain Assessment in Advanced Dementia Scale (PAINAD)
Interbeoordelaarsbetrouwbaarheid
Siok et al. vonden vier studies die een goede interbeoordelaarsbetrouwbaarheid rapporteerden [Siok 2012]. De Pearsons r varieerde van 0,75 tot 0,97 en Cohens kappa was 0,54 bij beweging en 0,31 in rust. Lichtner et al. Rapporteerden Pearsons r van 0,72 tot 0,97 [Lichtner 2014]. Ellis-Smith et al. vonden twee studies die Cohens kappa van 0,87 en een ICC ≥ 0,87 rapporteerden [Ellis-Smith 2016]. Ze vonden echter nog een derde studie die een ICC van 0,24 in rust rapporteerden en van 0,80 bij beweging.
Mosele et al. vonden een goede interbeoordelaarsbetrouwbaarheid voor de Italiaanse versie van het PAINAD-instrument (Cohens kappa=0,76-0,77 voor dementerende cliënten) [Mosele 2012]. Ammaturo et al. rapporteerden een ICC van 0,96 voor de Engelse versie [Ammaturo 2017]. Lukas et al. vonden Cohens kappa van 0,742 voor de Duitse versie van het PAINAD-instrument [Lukas 2013].
Sheu et al. rapporteerden voor de gelaatsuitdrukkingcomponent een Cohens kappa van -0,10 tot 0,39 voor milde pijn, 0,10 tot 0,40 voor matige pijn en 0,23 tot 0,54 voor ernstige pijn [Sheu 2011].
Test-hertestbetrouwbaarheid
Siok et al. vonden twee studies die een goede test-hertestbetrouwbaarheid rapporteerden [Siok 2012]. De Pearsons r varieerde van 0,89 tot 0,90.
Lukas et al. vonden Cohens kappa van 0,553 voor de Duitse versie van het PAINAD-instrument [Lukas 2013].
Interne consistentie
Siok et al. vonden vier studies die tegenstrijdige resultaten rapporteerden wat de interne consistentie betreft [Siok 2012]. De eerste studie vond een eerder lage Cronbachs alfa (0,50 tot 0,67) voor drie vormen van activiteit (geen activiteit, aangename of onaangename activiteit). De tweede studie vond een Cronbachs alfa van -0,04 tot 0,73 in rust en 0,70 tot 0,72 bij beweging. De derde studie rapporteerde een Cronbachs alfa van 0,69 tot 0,74 voor de Nederlandse versie van het PAINAD-instrument. De vierde studie rapporteerde een betere Cronbachs alfa van 0,85 tot 0,86 voor de Duitse versie. Lichtner et al. gaven geen bijkomende informatie [Lichtner 2014].
Mosele et al. vonden een goede interne consistentie voor de Italiaanse versie van het PAINAD-instrument (Cronbachs alfa=0,90 voor dementerende cliënten) [Mosele 2012].
Ammaturo et al. evalueerden de interne consistentie van de Engelse versie op twee manieren (Ammaturo 2017) De Cronbachs alfa bedroeg 0,61, de Spearman-Brown coëfficiënt 0,65.
Concurrente en convergente validiteit
Siok et al. vonden een goede correlatie tussen het PAINAD-instrument en de VAS-score in één studie (Pearsons r=0,75-0,95) [Siok 2012]. In een tweede studie werd een goede correlatie gevonden met het PACSLAC-instrument (Pearsons r=0,85). Lichtner et al. rapporteerden ook nog correlaties met DS-DAT (0,56-0,76), Doloplus-2 (0,34) en REPOS (0,61-0,75) [Lichtner 2014].
Mosele et al. vonden een goede concurrente validiteit van de Italiaanse versie van het PAINAD-instrument in vergelijking met een NRS-schaal (Kendall’s tau=0,77 voor dementerende cliënten) [Mosele 2012].
Ammaturo et al. vonden een positieve correlatie tussen de meeste scores met het PACSLAC-II instrument en het PAINAD-instrument (Engelse versie) voor de 7 getoonde pijnvideo’s, zowel voor leken (Pearsons r=0,12 tot 0,60) als voor zorgkundigen (Pearsons r=0,24 tot 0,40) [Ammaturo 2017]. Lukas et al. vonden een lage correlatie tussen drie zelfrapportage schalen en de Duitse versie van het PAINAD-instrument in rust (Spearmans r=0,093-0,335) [Lukas 2013]. Bij beweging was de correlatie beter (Spearmans r=0,382-0,435).
In een tweede studie vonden Lukas et al. tijdens beweging matige tot goede correlaties tussen de Duitse versie van het PAINAD-instrument en het BISAD-instrument (Spearmans r =0,61-0,81), het CNPI-instrument (Spearmans r=0,62-0,75) en het Algoplus-instrument (Spearmans r=0,59-0,73) [Lukas 2019].
Sheu et al. rapporteerden voor de correlatie tussen de gelaatsuitdrukkingcomponent en het FACS-systeem een Pearsons r van 0,41 voor milde pijn, 0,58 voor matige pijn en 0,55 voor ernstige pijn [Sheu 2011].
Discriminerende validiteit
Siok et al. vonden drie studies die de discriminerende validiteit evalueerden [Siok 2012]. In een eerste studie varieerde de gemiddelde pijnscore van 1,3 zonder stimulatie, over 1,0 tijdens een aangename activiteit, naar 3,1 tijdens een onaangename activiteit [Siok 2012]. In een tweede studie hadden cliënten die pijn hadden een hogere PAINAD-score (Duitse versie) dan cliënten zonder pijn (ochtend: 4,39 versus 2,15; avond: 4,52 versus 2,30). Een derde studie vond statistisch significant hogere PAINAD-scores bij beweging dan in rust (p<0,001) [Siok 2012].
Jordan et al. rapporteerden een verbetering in pijn gemeten met de Engelse versie van het PAINAD-instrument 1 maand na pijnbehandeling (gemiddelde score: pre 5, post 3,23; p=0,008) [Jordan 2011].
Diagnostische accuratesse
Jordan et al. rapporteerden voor de Engelse versie van het PAINAD-instrument een sensitiviteit van 92% en een specificiteit van 61% bij een afkapwaarde van 2 [Jordan 2011]. Zwakhalen et al. (Nederlandse versie) vonden een sensitiviteit van 100% en een specificiteit van 48% wanneer een afkapwaarde van 1 gehanteerd werd en een sensitiviteit van 93% en een specificiteit van 77% bij een afkapwaarde van 2 [Zwakhalen 2012].
Andere
Fry et al. vonden geen statistisch significant effect van het gebruik van het PAINAD-instrument (Engelse versie) op de tijd tot de eerste dosis pijnmedicatie (hazard ratio=0,97; 95% BI 0,80 tot 1,17; p=0,74) of de proportie cliënten die binnen de 60 minuten pijnmedicatie kregen (PAINAD 28% vs. standaardzorg 32%; p=0,19) [Fry 2018].
(10) Rotterdam Elderly Pain Observation Scale (REPOS)
Siok et al. vonden één studie met hoofdzakelijk dementerende ouderen die een goede interbeoordelaarsbetrouwbaarheid rapporteerde (ICC=0,92) [Siok 2012]. De intrabeoordelaarsbetrouwbaarheid was eveneens goed (ICC=0,90-0,96) [Siok 2012, Lichtner 2014]. De interne consistentie was matig (Kuder-Richardson=0,49) [Siok 2012]. Deze studie vond een lage correlatie met VRS-scores (Verbal Rating Scale) door verpleegkundigen (Pearsons r=-0,12 tot 0,39) [Siok 2012]. Een sterke correlatie met het PAINAD-instrument werd gerapporteerd (Pearsons r=0,61-0,75) [Siok 2012].
Tenslotte werd een statistisch significant verschil in pijnscore gerapporteerd tussen activiteit en rust (p<0,001) [Siok 2012]. Een REPOS-score van 3 had een sensitiviteit van 85% en een specificiteit van 83%.
(11) Electronic Pain Assessment Tool (ePAT)
Interbeoordelaarsbetrouwbaarheid
In een eerste studie vonden Atee et al. een zeer goede interbeoordelaarsbetrouwbaarheid, zowel gemeten met Cohens kappa (gewogen kappa: totaal 0,857; rust 0,840; beweging 0,772) als met de intra-class coëfficiënt (totaal 0,904; rust 0,902; beweging 0,879) [Atee 2017a]. In een tweede studie was de interbeoordelaarsbetrouwbaarheid lager, maar nog steeds goed (gewogen kappa: totaal 0,74; rust 0,71; beweging 0,78) (Atee 2017b). In een derde studie, tenslotte, rapporteerden Atee et al. een zeer goede interbeoordelaarsbetrouwbaarheid voor de beoordeling van pijn in vier grote categorieën in rust (Cohens kappa=1,0) en een matige betrouwbaarheid bij beweging (Cohens kappa=0,59) [Atee 2018]. Ook voor de totale scores was er een zeer goede betrouwbaarheid (Lins concordance correlation coefficient=0,92).
Interne consistentie
Atee et al. vonden algemeen een goede interne consistentie in vergelijking met de APS-schaal (Cronbachs alfa=0,950) en die was hoger na beweging (0,797) dan in rust (0,766) [Atee 2017a]. Ook in een tweede studie vonden Atee et al. een goede interne consistentie in vergelijking met de APS-schaal (Cronbachs alfa=0,925) [Atee 2017b].
Concurrente en criterium validiteit
Atee et al. vonden een goede correlatie tussen het ePAT-instrument en de APS-schaal (Pearsons r: totaal 0,911; rust 0,896; beweging 0,904) [Atee 2017a]. De correlatie was niet situatie-afhankelijk (p=0,243). Ook in een tweede studie vonden Atee et al. een goede correlatie tussen het ePAT-instrument en de APS-schaal (Pearsons r: totaal 0,822; rust 0,880; beweging 0,894) [Atee 2017b] Ook hier was de correlatie niet situatie-afhankelijk (p=0,795).
Predictieve validteit
Atee et al. vonden statistisch significant hogere gemiddelde pijnscores na beweging dan in rust (11,44 vs. 8,33; p<0,0001) [Atee 2017a].
(12) Algoplus
Concurrente en criterium validiteit
Bonin-Guillaume et al. vonden een goede correlatie met de NRS-schaal (dementie: Spearmans r=0,91; dementie en depressie: Spearmans r=0,78) en de Doloplus-schaal (dementie: Spearmans r=0,87; dementie en depressie: Spearman correlatie coëfficiënt=0,86) [Bonin-Guillaume 2016].
Lukas et al. vonden matige tot goede correlaties met het PAINAD-instrument (Spearman correlatie coëfficiënt 0,59-0,73), het BISAD-instrument (Spearmans r=0,41-0,63) en het CNPI-instrument (Spearmans r=0,58-0,78) [Lukas 2019].
Predictieve validteit
Bonin-Guillaume et al. rapporteerden statistisch significant lagere Algoplus-scores na pijnbehandeling (dementie: -2,4 +/- 1,5; p<0,001; dementie en depressie: -2,5 +/- 1,2; p<0,001) [Bonin-Guillaume 2016].
Diagnostische accuratesse
Wanneer een afkapwaarde van 2 als score gehanteerd werd, rapporteerden Bonin-Guillaume et al. een sensitiviteit van 95% en een specificiteit van 96% voor cliënten met dementie en sensitiviteit van 96% en een specificiteit van 71% voor cliënten met dementie en depressie [Bonin-Guillaume 2016]. Wanneer een afkapwaarde van 3 als score gehanteerd werd, was de sensitiviteit 80% en 83%, respectievelijk, en de specificiteit 100% en 95%, respectievelijk.
(13) Facial Action Coding System (FACS)
Interbeoordelaarsbetrouwbaarheid
Lichtner et al. rapporteerden een Pearsons r van 0,82 tot 0,92 [Lichtner 2014].
Erin Browne et al. rapporteerden een Pearsons r van 0,92 tot 0,99 voor pijncodering op basis van het FACS-systeem [Erin Browne 2019].
Intra-rater betrouwbaarheid
Lichtner et al. rapporteerden een Pearsons r van 0,88 tot 0,97 [Lichtner 2014].
Concurrente en criterium validiteit
Sheu et al. rapporteerden voor de correlatie tussen het FACS-systeem en de gelaatsuitdrukkingscomponent van de volgende 6 instrumenten een Pearsons r van: NOPPAIN 0,35 voor milde pijn, 0,70 voor matige pijn en 0,59 voor ernstige pijn; PAINAD 0,41 voor milde pijn, 0,58 voor matige pijn en 0,55 voor ernstige pijn; Abbey Pain Scale 0,26 voor milde pijn, 0,67 voor matige pijn en 0,63 voor ernstige pijn; Mahoney Pain Scale 0,45 voor milde pijn, 0,68 voor matige pijn en 0,59 voor ernstige pijn; Doloplus-2 -0,13 voor milde pijn, 0,16 voor matige pijn en 0,1 voor ernstige pijn; PACSLAC 0,09 voor milde pijn, 0,76 voor matige pijn en 0,65 voor ernstige pijn [Sheu 2011].
(14) Pain Intensity Measure for Persons with Dementia (PIMD)
Ersek et al. rapporteerden een goede interbeoordelaarsbetrouwbaarheid met een ICC van 0,70 in rust en 0,82 bij beweging [Ersek 2019]. De interne consistentie was laag tot matig met een Cronbachs alfa van 0,18 in rust en 0,72 bij beweging.
Ersek et al. vonden een goede correlatie met pijnevaluaties door klinische experts (Pearsons r=0,49-0,75) en met de MOBID-schaal (Pearsons r=0,59) bij beweging, maar niet in rust (Pearsons r=0,03 tot 0,14 en 0,24, respectievelijk) [Ersek 2019].
(15) Doloshort
Likar et al. rapporteerden een goede interbeoordelaarsbetrouwbaarheid (Pearsons r=0,946 tot 0,964) en een goede intra-beoordelaarsbetrouwbaarheid (Pearsons r=0,949 tot 0,970) [Likar 2015].
(16) Multidimensional Objective Pain Assessment Tool (MOPAT)
McGuire et al. rapporteerden een Cronbachs alfa van 0,85 voor de gedrag-subschaal en 0,78 voor de fysiologische subschaal (McGuire 2011). Ze rapporteerden eveneens een statistisch significante verbetering van de pijnscores gemeten met het MOPAT-instrument na pijnbehandeling (gedrag: pre 6,67 versus post 2,55; fysiologisch: pre 2,23 versus post 0,86; p<0.001) [McGuire 2011].
(17) Iowa Pain Thermometer
Ware et al. vonden een goede test-hertestbetrouwbaarheid (Spearman rank correlatie) van 0,80 voor de herziene versie van de Iowa Pain Thermometer en 0,79 voor het originele instrument [Ware 2015].
Ze rapporteerden ook een goede correlatie tussen de originele en herziene versie van de Iowa Pain Thermometer voor cliënten met een verstandelijke beperking (Spearman rank correlatie=0,87-0,95) [Ware 2015]. Ook tussen de herziene versie en een numerieke rating schaal was er een goede correlatie (Spearman rank correlatie=0,91-0,94).
(18) Pain and Discomfort Scale (PADS)
Shinde et al. rapporteerden een goede sensitiviteit, specificiteit en convergentie [Shinde, 2014]. Deelnemers waren betrouwbaar gecodeerd met zowel de FACS- als de PADS-benaderingen als reactie op de sensorische stimuli (FACS 4,71; p <0,05; PADS 21,49; p <0,05) (gevoeligheid), en reageerden vrijwel niet op de placebobenadering (FACS 3,77; p=0,06; PADS 5.87; p=0,02) (specificiteit). De PADS-scores waren vergelijkbaar met de FACS-scores en waren statistisch significant gecorreleerd (Spearman rank correlatie=0,41 tot 0,51, p <0,01) (convergentie).
(19) Non-Communicating Adults Pain Checklist (NCAPC)
Meir et al. construeerden een model om pijnreactie weer te geven. Pijngedrag werd beoordeeld door een waarnemer. De test-hertest of interbeoordelaarsbetrouwbaarheid is niet onderzocht. Er lijkt onderscheid mogelijk tussen twee categorieën pijnreacties: een basisreactie bestaande uit fysiologische maatregelen en lichaamsreactie, en een geavanceerde reactie bestaande uit vocale en emotionele reacties, evenals gezichts- en beschermende uitdrukkingen. De analyse resulteerde in een tweedelig model: Goodness of Fit Index (GFI)=0,98, Normed Fit Index (NFI)=0,92 en Non-Normed Fit Index (NNFI)=1,00. Het model had een statistisch significante voorspellende waarde met betrekking tot het ''geavanceerde'' deel van het model (0,71, T=3,91) [Meir 2012].
Validatie en generalisatie bracht een soortgelijk model tot stand met de volgende eigenschappen: GFI=0,99, NFI=0,96, NNFI=1,00, RMSEA=0,00, hetgeen wijst op een perfecte modelpassing. De psychometrische eigenschappen zijn gepubliceerd in de studie van Lotan et al [Lotan 2009].
(20) Andere pijninstrumenten voor volwassen
Interbeoordelaarsbetrouwbaarheid
Lichtner et al. rapporteerden de interbeoordelaarsbetrouwbaarheid voor de volgende instrumenten: FLACC (Cohens kappa=0,40), PAINE (Pearsons r=0,71 tot 0,99), RaPID (Pearsons r=0,97), DS-DAT (Pearsons r=0,61 tot 0,98; ICC=0,74), PBM (ICC=0,10 tot 0,87), PADE (ICC=0,54 tot 0,96), ECPA (ICC=0,80) en ECPA-2 (ICC=0,852 tot 0,897) [Lichtner 2014]. Beoordeling van dit bewijs is moeilijk, gezien het gebaseerd is op een review van reviews en onduidelijk is wat het aandeel dementerende cliënten was.
Test-hertestbetrouwbaarheid
Lichtner et al. rapporteerden een ICC van 0,70 tot 0,98 voor het PADE-instrument [Lichtner 2014]. Beoordeling van dit bewijs is moeilijk, gezien het gebaseerd is op een review van reviews en onduidelijk is wat het aandeel dementerende cliënten was.
Zhou et al. rapporteerden bij cliënten met een milde verstandelijke beperking een goede test-rest betrouwbaarheid met Pearsons r van 0,84 voor het VDS-instrument, 0,80 voor het FPS-instrument, 0,76 voor het CAS-instrument en 0,77 voor het BS-21 instrument [Zhou 2011].
Interbeoordelaarsbetrouwbaarheid
Lichtner et al. rapporteerden de interbeoordelaarsbetrouwbaarheid voor de volgende instrumenten: PAINE (Pearsons r=0,711 tot 0,999), RaPID (Pearsons r>0,75) en DS-DAT (Pearsons r=0,6) [Lichtner 2014]. Beoordeling van dit bewijs is moeilijk, gezien het gebaseerd is op een review van reviews en onduidelijk is wat het aandeel dementerende cliënten was.
Interne consistentie
Lichtner et al. rapporteerden de interne consistentie voor de volgende instrumenten: PAINE (0,75-0,78), RaPID (0,79), PADE (0,24-0,88), PATCOA (0,44), ECPA (0,70) en EPCA-2 (0,73- 0,79) [Lichtner 2014]. Beoordeling van dit bewijs is moeilijk, gezien het gebaseerd is op een review van reviews en onduidelijk is wat het aandeel dementerende cliënten was.
Concurrente en criterium validiteit
Zhou et al. rapporteerden bij cliënten met lichte verstandelijke beperking een goede correlatie van het VDS-instrument met het FPS-instrument (r=0,84), het CAS-instrument (r=0,82) en het BS-21 instrument (r=0,83) [Zhou 2011].
(21) Pijninstrumenten voor kinderen
Communicating Child's Pain Checklist – Postoperative Version (NCCPC-PV)
Interbeoordelaarsbetrouwbaarheid
Crosta et al. rapporteerden een ICC van 0,78 voor onderzoekers en 0,82 voor zorgverleners (1 studie) [Crosta 2014]. Massaro et al. rapporteerden een ICC tussen 0,43 en 0,69 [Massaro 2014].
Interne consistentie
Crosta et al. rapporteerden een Cronbachs alfa van 0,71 voor onderzoekers en 0,91 voor zorgverleners (1 studie) [Crosta 2014].
Concurrente en criterium validiteit
Crosta et al. rapporteerden een positieve correlatie tussen het NCCPC-PV instrument en de VAS-schaal, maar cijfers werden niet gerapporteerd [Crosta 2014].
Massaro et al. rapporteerden een positieve correlatie tussen het NCCPC-PV instrument en het DESS-instrument (Spearmans r=0,76; Cohens kappa=0,61) en het CHEOPS-instrument (Spearmans r=0,66; Cohens kappa=0,58) [Massaro 2014].
Individualized Numeric Rating Scale (INRS)
Crosta et al. rapporteerden een goede tot zeer goede interbeoordelaarsbetrouwbaarheid met een ICC van 0,65-0,87 (één studie) [Crosta 2014]. Ze rapporteerden ook een matige correlatie tussen de INRS-schaal en het NCCPC-PV instrument (1 studie; Pearsons r=0,63-0,73) [Crosta 2014].
Pediatric Pain Profile (PPP)
Crosta et al. rapporteerden een goede tot zeer goede interbeoordelaarsbetrouwbaarheid met een ICC van 0,70-0,87 (1 studie) [Crosta 2014]. Ze rapporteerden ook een goede interne consistentie (één studie; Cronbachs alfa=0,75-0,89) [Crosta 2014].
Revised Face, Leg, Activity, Cry and Consolability scale (r-FLACC)
Crosta et al. rapporteerden een zeer goede interbeoordelaarsbetrouwbaarheid met een ICC van 0,90 (1 studie) [Crosta 2014]. Ze rapporteerden ook een zeer goede test-hertestbetrouwbaarheid met een ICC van 0,97 (1 studie) [Crosta 2014)]
Echelle Douleur Enfant San Salvador (DESS)
Massaro et al. rapporteerden een goede interbeoordelaarsbetrouwbaarheid met een ICC tussen 0,67 en 0,78 (Massaro 2014). Ze rapporteerden een positieve correlatie tussen het DESS-instrument en het NCCPC-PV instrument (Spearmans r=0,76; Cohens kappa=0,61) en het CHEOPS-instrument (Spearmans r=0,67; Cohens kappa=0,51) [Massaro 2014].
Children’s Hospital of Eastern Ontario Pain Scale (CHEOPS)
Massaro et al. rapporteerden een matige interbeoordelaarsbetrouwbaarheid met een ICC tussen 0,54 en 0,72 [Massaro 2014]. Ze rapporteerden een positieve correlatie tussen het CHEOPS-instrument en het NCCPC-PV instrument (Spearman’s r=0,66; Cohens kappa=0,58) en het DESS-instrument (Spearmans r=0,67; Cohens kappa=0,51) [Massaro 2014].
| EBRO Niveau 2 |
Het beschikbare bewijs over de psychometrische eigenschappen van de Abbey Pain Scale toont uiteenlopende resultaten voor de detectie van pijn bij dementerende cliënten, met een matige tot zeer goede interbeoordelaarsbetrouwbaarheid, een goede test-hertestbetrouwbaarheid, een zeer matige tot goede interne consistentie, een matige tot goede convergente validiteit en een goede discriminerende validiteit. B [Siok 2012, Lichtner 2014, Sheu 2011, Atee 2017a, Atee 2017b] |
| EBRO Niveau 2 |
Het is aannemelijk dat de psychometrische eigenschappen van de Checklist of Nonverbal Pain Indicators eerder m[atig zijn voor de detectie van pijn bij dementerende cliënten. B [Siok 2012, Lichtner 2014, Lukas 2019] |
| EBRO Niveau 3 |
Er zijn aanwijzingen dat de psychometrische eigenschappen van de Certified Nursing Assistant Pain Assessment Tool goed zijn voor de detectie van pijn bij dementerende cliënten. B [Siok 2012, Lichtner 2014] |
| EBRO Niveau 2 |
Het is aannemelijk dat de psychometrische eigenschappen van de Doloplus-2 schaal goed zijn voor de detectie van pijn bij dementerende cliënten. B [Rostad 2017, Siok 2012, Lichtner 2014, Bonin-Guillaume 2016, Sheu 2011] |
| EBRO Niveau 2 |
Het is aannemelijk dat de psychometrische eigenschappen van de Mahoney Pain Scale matig zijn voor de detectie van pijn bij dementerende cliënten (EBRO Niveau 2). De diagnostische accuratesse is zeer goed (EBRO Niveau 3). B [Siok 2012, Lichtner 2014, Sheu 2011] |
| EBRO Niveau 2 |
Het is aannemelijk dat de psychometrische eigenschappen van de MOBID(-2)-schaal matig tot goed zijn voor de detectie van pijn bij dementerende cliënten. B [Siok 2012, Lichtner 2014, Husebo 2014, Ersek 2019] |
| EBRO Niveau 2 |
Het is aannemelijk dat de psychometrische eigenschappen van het NOPPAIN-instrument goed tot zeer goed zijn voor de detectie van pijn bij dementerende cliënten. B [Siok 2012, Lichtner 2014, Ellis-Smith 2016, Sheu 2011] |
| EBRO Niveau 2 |
Het is aannemelijk dat de psychometrische eigenschappen van het PACSLAC-instrument goed tot zeer goed zijn voor de detectie van pijn bij dementerende cliënten. B [Siok 2012, Lichtner 2014, Ellis-Smith 2016, Ammaturo 2017, Erin Browne 2019, Haghi 2019, Sheu 2011, The 2016, Chan 2014] |
| EBRO Niveau 2 |
Het is aannemelijk dat de psychometrische eigenschappen van het PAINAD-instrument goed zijn voor de detectie van pijn bij dementerende cliënten. De sensitiviteit is zeer goed, maar de specificiteit niet. B [Siok 2012, Lichtner 2014, Ellis-Smith 2016, Ammaturo 2017, Mosele 2012, Lukas 2013, Sheu 2011, Jordan 2011, Lukas 2019, Fry 2018] |
| EBRO Niveau 3 |
Er zijn aanwijzingen dat de psychometrische eigenschappen van de Rotterdam Elderly Pain Observation Scale matig tot goed zijn voor de detectie van pijn bij dementerende cliënten. De diagnostische accuratesse is matig. B [Siok 2012, Lichtner 2014] |
| EBRO Niveau 2 |
Het is aannemelijk dat de psychometrische eigenschappen van de Electronic Pain Assessment Tool zeer goed zijn voor de detectie van pijn bij dementerende cliënten. B [Atee 2017a, Atee 2017b, Atee 2018] |
| EBRO Niveau 3 |
Er zijn aanwijzingen dat de psychometrische eigenschappen van de Algoplus-schaal matig tot goed zijn voor de detectie van pijn bij dementerende cliënten. De diagnostische accuratesse is zeer goed bij een afkapwaarde van 2. B [Bonin-Guillaume 2016, Lukas 2019] |
| EBRO Niveau 2 |
Het is aannemelijk dat de psychometrische eigenschappen van het Facial Action Coding System zeer goed zijn voor de detectie van pijn bij dementerende cliënten. B [Lichtner 2014, Erin Browne 2019, Sheu 2011] |
| EBRO Niveau 3 |
Er zijn aanwijzingen dat de psychometrische eigenschappen van de Pain Intensity Measure for Persons with Dementia matig zijn voor de detectie van pijn bij dementerende cliënten. B [Ersek 2019] |
| EBRO Niveau 3 |
Er zijn aanwijzingen dat de psychometrische eigenschappen van de Doloshort-schaal goed zijn voor de detectie van pijn bij dementerende cliënten. B [Likar 2015] |
| EBRO Niveau 3 |
Er zijn aanwijzingen dat de psychometrische eigenschappen van de Multidimensional Objective Pain Assessment Tool goed zijn voor de detectie van pijn bij dementerende cliënten. B [McGuire 2011] |
| EBRO Niveau 3 |
Er zijn aanwijzingen dat de psychometrische eigenschappen van de Iowa Pain Thermometer goed zijn voor de detectie van pijn bij dementerende cliënten. B [Ware 2015] |
| EBRO Niveau 3 |
Er zijn aanwijzingen dat de psychometrische eigenschappen van de Verbal Descriptor Scale (VDS) goed zijn voor de detectie van pijn bij cliënten met lichte verstandelijke beperking. B [Zhou 2011] |
| EBRO Niveau 3 |
Er zijn aanwijzingen dat de Pain and Discomfort Scale (PADS) goede psychometrische eigenschappen heeft voor het evalueren van ongemak en pijn van mensen met een verstandelijke beperking die moeite hebben met of niet kunnen spreken. B [Shinde 2014] |
| EBRO Niveau 3 |
Er zijn aanwijzingen dat een model om pijngedrag te evalueren afgeleid van de Non-Communicating Adults Pain Checklist een goede constructvaliditeit vertoont met betrekking tot acute procedurele pijn bij mensen met verstandelijke beperking. B [Meir 2012] |
In het kader van deze richtlijn is een literatuurstudie uitgevoerd naar diverse meetinstrumenten naar pijn bij cliënten met beperkte communicatiemogelijkheden door verstandelijke beperking of dementie. Aan de hand van deze literatuurstudie zijn 21 meetinstrumenten beoordeeld.
Als matig (tot goed) scoorden hierbij de volgende instrumenten:
- Abbey Pain Scale,
- Checklist of Nonverbal Pain Indicators Checklist of Nonverbal Pain Indicators,
- Mahoney Pain Scale,
- MOBID(-2)-scale,
- Rotterdam Elderly Pain Observation Scale (REPOS),
- Algoplus-schaal,
- Pain Intensity Measure for Persons with Dementia.
Als goed werden beoordeeld:
- Certified Nursing Assistant Pain Assessment Tool,
- Doloplus-2 schaal,
- PAINAD-instrument,
- Doloshort-schaal,
- Multidimensional Objective Pain Assessment Tool,
- Lowa Pain Thermometer,
- Verbal Descriptor Scale (VDS),
- Pain and Discomfort Scale (PADS),
- Afgeleide van de Non-Communicating Adults Pain Checklist.
Als goed tot zeer goed werden beoordeeld bij ouderen met cognitieve beperking:
- NOPPAIN-instrument,
- PACSLAC-instrument.
Als zeer goed werden beoordeeld bij ouderen en dementerenden:
- Electronic Pain Assessment Tool,
- Facial Action Coding System.
Bij de literatuurstudie naar pijninstrumenten voor volwassenen met een verstandelijke beperking werd ook een aantal pijninstrumenten voor kinderen als bijvangst gevonden. Omdat hiernaar geen gerichte studie was verricht, zijn deze studies vanuit methodologisch perspectief buiten beschouwing gelaten in de conclusies.
In het eerder genoemde addendum ‘meetinstrumenten in de palliatieve zorg’ van het kwaliteitskader palliatieve zorg zijn de volgende gevalideerde meetinstrumenten opgenomen voor het monitoren van pijn bij mensen met een verstandelijke beperking en/of bij ouderen met uitingsproblemen/dementie:
- REPOS,
- PAINAD,
- PACSLAC-D.
In de literatuurstudie werd voor de doelgroep de REPOS als matig (tot goed) beoordeeld, de PAINAD als goed en de PACSLAC als goed tot zeer goed. Voor alle 3 de pijnmonitoringsschalen is scholing vooraf nodig.
Een van de uitgangspunten van deze richtlijn is om dicht bij het karakter van het kwaliteitskader palliatieve zorg te blijven. Uit bovenstaande volgt dat het gebruik van de PAINAD en de PACSLAC voorkeur verdient in de beoordeling en monitoring van de pijn bij palliatieve cliënten met verstandelijke beperking. In de gevonden literatuur werden slechts 2 studies gevonden bij volwassenen met verstandelijke beperking. Na de literatuursearch is het artikel Validity of the Rotterdam Elderly Pain Observation Scale for institutionalised cognitively impaired Dutch adults [Boerlage 2022] gepubliceerd. Op basis van dit artikel kan ook de inzet van de REPOS overwogen worden voor het meten van pijn bij mensen met een verstandelijke beperking.
Behandeling
Behandeling van pijn bij mensen met een verstandelijke beperking in de palliatieve fase is veelal niet anders dan bij andere cliënten. Hiervoor wordt verwezen naar de richtlijn Pijn bij patiënten met kanker.
Wel is aandacht voor de atypische presentatie zoals hierboven vermeld van belang. Mensen met een verstandelijke beperking zijn vaak afhankelijk van 24-uurs ondersteuning door diverse zorgverleners. Evaluatie van de pijn met client, ouders/verzorgers en behandelend arts middels invullen van gevalideerde schalen voorafgaand en na inzetten van pijnmedicatie is daarom des te meer van belang om goed overzicht te houden op het effect van pijnmedicatie op de pijn/het pijngedrag. Zorgverleners zullen cliënten hierin moeten ondersteunen of dit voor de moeten cliënt doen. Indien de (huis)arts moeite heeft met het duiden van het effect op pijn in verband met communicatieve beperkingen bij de cliënt, kan verwezen worden naar de arts VG.
Medicamenteuze behandeling
Zie verder de hierboven genoemde richtlijnen Pijn bij patiënten met kanker en Pijn bij gevorderde stadia van COPD en hartfalen of voor huisartsen de NHG-standaard Pijn.
Naast de medicamenteuze behandeling is ook de niet-medicamenteuze behandeling ten aanzien van zowel de somatische, psychische, sociale en spirituele dimensies van belang. Breng de eventuele problemen op dit gebied goed in kaart en neem interventies hiervoor op in behandelplannen. Voor suggesties verwijzen we naar de richtlijnen pijn in de palliatieve fase.
Agora, Ervaringen en uitdagingen! Palliatieve zorg in de zorg voor mensen met een verstandelijke beperking’, 2017.
Ammaturo DA, Hadjistavropoulos T, Williams J. Pain in Dementia: Use of Observational Pain Assessment Tools by People Who Are Not Health Professionals. Pain Med. 2017;18(10):1895-907.
Atee M, Hoti K, Hughes JD. Psychometric Evaluation of the Electronic Pain Assessment Tool: An Innovative Instrument for Individuals with Moderate-to-Severe Dementia. Dement Geriatr Cogn Disord. 2017;44(5-6):256-67.
Atee M, Hoti K, Parsons R, Hughes JD. A novel pain assessment tool incorporating automated facial analysis: interbeoordelaars reliability in advanced dementia. Clin Interv Aging. 2018;13:1245-58.
Atee M, Hoti K, Parsons R, Hughes JD. Pain Assessment in Dementia: Evaluation of a Point-of-Care Technological Solution. J Alzheimers Dis. 2017;60(1):137-50.
Boerlage AA, Sneep L, van Rosmalen J, van Dijk M. Validity of the Rotterdam Elderly Pain Observation Scale for institutionalised cognitively impaired Dutch adults. J Intellect Disabil Res. 2021 Jul;65(7):675-687
Bonin-Guillaume S, Jouve E, Lauretta R, Nalin C, Truillet R, Capriz F, et al. Algoplus performance to detect pain in depressed and/or demented old patients. Eur J Pain. 2016;20(7):1185-93.
Chan S, Hadjistavropoulos T, Williams J, Lints-Martindale A. Evidence-based development and initial validation of the pain assessment checklist for seniors with limited ability to communicate-II (PACSLAC-II). Clin J Pain. 2014;30(9):816-24.
Chen YH, Lin LC, Watson R. Evaluation of the psychometric properties and the clinical feasibility of a Chinese version of the Doloplus-2 scale among cognitively impaired older people with communication difficulty. Int J Nurs Stud. 2010;47(1):78-88.
Chen YH, Lin LC. The Credibility of Self-reported Pain Among Institutional Older People with Different Degrees of Cognitive Function in Taiwan. Pain Manag Nurs. 2015;16(3):163-72.
Coca SM, Abeldano Zuniga RA. Instruments for pain assessment in patients with advanced dementia: A systematic review of the evidence for Latin America. Palliat Support Care. 2020:1-7.
Corbett A, Achterberg W, Husebo B, Lobbezoo F, de Vet H, Kunz M, et al. An international road map to improve pain assessment in people with impaired cognition: The development of the Pain Assessment in Impaired Cognition (PAIC) meta-tool. BMC Neurol. 2014;14(1).
Crosta QR, Ward TM, Walker AJ, Peters LM. A review of pain measures for hospitalized children with cognitive impairment. J Spec Pediatr Nurs. 2014;19(2):109-18.
Ellis-Smith C, Evans CJ, Bone AE, Henson LA, Dzingina M, Kane PM, et al. Measures to assess commonly experienced symptoms for people with dementia in long-term care settings: A systematic review. BMC Med. 2016;14(1).
Erin Browne M, Hadjistavropoulos T, Prkachin K, Ashraf A, Taati B. Pain Expressions in Dementia: Validity of Observers' Pain Judgments as a Function of Angle of Observation. Journal of Nonverbal Behavior. 2019;43(3):309-27.
Van Dalen-Kok AH, Achterberg WP, Rijkmans WE, Tukker-van Vuuren SA, Delwel S, de Vet HC, et al. Pain Assessment in Impaired Cognition (PAIC): content validity of the Dutch version of a new and universal tool to measure pain in dementia. Clin Interv Aging. 2018;13:25-34.
Ersek M, Herr K, Neradilek MB, Buck HG, Black B. Comparing the psychometric properties of the Checklist of Nonverbal Pain Behaviors (CNPI) and the Pain Assessment in Advanced Dementia (PAIN-AD) instruments. Pain Med. 2010;11(3):395-404.
Ersek M, Neradilek MB, Herr K, Hilgeman MM, Nash P, Polissar N, et al. Psychometric evaluation of a pain intensity measure for persons with dementia. Pain Medicine (United States). 2019;20(6):1093-104.
Fry M, Chenoweth L, Arendts G. Can an observational pain assessment tool improve time to analgesia for cognitively impaired older persons? A cluster randomised controlled trial. Emerg Med J. 2018;35(1):33-8.
Haghi M, Fadayevatan R, Alizadeh-Khoei M, Kaboudi B, Foroughan M, Mahdavi B. Validation of Pain Assessment Checklist for Seniors with Limited Ability to Communicate-II (PACSLAC-II) in Iranian older adults with dementia living in nursing homes. Psychogeriatrics : the official journal of the Japanese Psychogeriatric Society. 2019.
Husebo BS, Ostelo R, Strand LI. The MOBID-2 pain scale: reliability and responsiveness to pain in patients with dementia. Eur J Pain. 2014;18(10):1419-30.
Husebo BS, Strand LI, Moe-Nilssen R, Husebo SB, Ljunggren AE. Pain in older persons with severe dementia. Psychometric properties of the Mobilization-Observation-Behaviour-Intensity-Dementia (MOBID-2) Pain Scale in a clinical setting. Scand J Caring Sci. 2010;24(2):380-91.
IKNL, Richtlijn Pijn bij patiënten met kanker, 2019, https://www.pallialine.nl/pijn-bij-patienten-met-kanker.
Jordan A, Hughes J, Pakresi M, Hepburn S, O'Brien JT. The utility of PAINAD in assessing pain in a UK population with severe dementia. Int J Geriatr Psychiatry. 2011;26(2):118-26.
Kaasalainen S, Akhtar-Danesh N, Hadjistavropoulos T, Zwakhalen S, Verreault R. A comparison between behavioral and verbal report pain assessment tools for use with residents in long term care. Pain Manag Nurs. 2013;14(4):e106-e14.
Kunz M, de Waal MWM, Achterberg WP, Gimenez-Llort L, Lobbezoo F, Sampson EL, et al. The Pain Assessment in Impaired Cognition scale (PAIC15): A multidisciplinary and international approach to develop and test a meta-tool for pain assessment in impaired cognition, especially dementia. European Journal of Pain (United Kingdom). 2020;24(1):192-208.
Lichtner V, Dowding D, Esterhuizen P, Closs SJ, Long AF, Corbett A, et al. Pain assessment for people with dementia: a systematic review of systematic reviews of pain assessment tools. BMC geriatr. 2014;14:138.
Likar R, Pipam W, Neuwersch S, Kostenberger M, Pinter G, Gatternig C, et al. [Pain measurement in cognitively impaired patients with the Doloshort scale]. Schmerz. 2015;29(4):440-4.
Lints-Martindale AC, Hadjistavropoulos T, Lix LM, Thorpe L. A comparative investigation of observational pain assessment tools for older adults with dementia. Clin J Pain. 2012;28(3):226-37.
Liu JY, Briggs M, Closs SJ. The psychometric qualities of four observational pain tools (OPTs) for the assessment of pain in elderly people with osteoarthritic pain. J Pain Symptom Manage. 2010;40(4):582-98.
Loeser JD, Melzack R. Pain: an overview. The Lancet 1999: 1607-1609
Lotan M, Ljunggren EA, Johnsen TB, Defrin R, Pick CG, Strand LI. A modified version of the non-communicating children pain checklist-revised, adapted to adults with intellectual and developmental disabilities: sensitivity to pain and internal consistency. J Pain. 2009;10(4):398-407.
Lukas A, Hagg-Grun U, Mayer B, Fischer T, Schuler M. Pain assessment in advanced dementia. Validity of the German PAINAD-a prospective double-blind randomised placebo-controlled trial. Pain. 2019;160(3):742-53.
Lukas A, Niederecker T, Gunther I, Mayer B, Nikolaus T. Self- and proxy report for the assessment of pain in patients with and without cognitive impairment: experiences gained in a geriatric hospital. Z Gerontol Geriatr. 2013;46(3):214-21.
Massaro M, Ronfani L, Ferrara G, Badina L, Giorgi R, D'Osualdo F, et al. A comparison of three scales for measuring pain in children with cognitive impairment. Acta Paediatr. 2014;103(11):e495-500.
McGuire DB, Reifsnyder J, Soeken K, Kaiser KS, Yeager KA. Assessing pain in nonresponsive hospice patients: development and preliminary testing of the multidimensional objective pain assessment tool (MOPAT). J Palliat Med. 2011;14(3):287-92.
Meir L, Strand LI, Alice K. A model for pain behavior in individuals with intellectual and developmental disabilities. Res Dev Disabil. 2012;33(6):1984-9.
Mosele M, Inelmen EM, Toffanello ED, Girardi A, Coin A, Sergi G, et al. Psychometric properties of the pain assessment in advanced dementia scale compared to self assessment of pain in elderly patients. Dement Geriatr Cogn Disord. 2012;34(1):38-43.
Neville C, Ostini R. A psychometric evaluation of three pain rating scales for people with moderate to severe dementia. Pain Manag Nurs. 2014;15(4):798-806.
Rostad HM, Utne I, Grov EK, Puts M, Halvorsrud L. Measurement properties, feasibility and clinical utility of the Doloplus-2 pain scale in older adults with cognitive impairment: a systematic review. BMC geriatr. 2017;17(1):257.
Sheu E, Versloot J, Nader R, Kerr D, Craig KD. Pain in the elderly: validity of facial expression components of observational measures. Clin J Pain. 2011;27(7):593-601.
Shinde SK, Danov S, Chen CC, Clary J, Harper V, Bodfish JW, Symons FJ. Convergent validity evidence for the Pain and Discomfort Scale (PADS) for pain assessment among adults with intellectual disability. Clin J Pain. 2014 Jun;30(6):536-43.
Siok Qi NG, Brammer JD, Creedy DK. The psychometric properties, feasibility and utility of behavioural-observation methods in pain assessment of cognitively impaired elderly people in acute and long-term care: A systematic review. JBI Library of Systematic Reviews. 2012;10(17):977-1085.
The KB, Gazoni FM, Cherpak GL, Lorenzet IC, Santos LA, Nardes EM, et al. Pain assessment in elderly with dementia: Brazilian validation of the PACSLAC scale. Einstein. 2016;14(2):152-7.
Ware LJ, Herr KA, Booker SS, Dotson K, Key J, Poindexter N, et al. Psychometric Evaluation of the Revised Iowa Pain Thermometer (IPT-R) in a Sample of Diverse Cognitively Intact and Impaired Older Adults: A Pilot Study. Pain Manag Nurs. 2015;16(4):475-82.
Zhou Y, Petpichetchian W, Kitrungrote L. Psychometric properties of pain intensity scales comparing among postoperative adult patients, elderly patients without and with mild cognitive impairment in China. Int J Nurs Stud. 2011;48(4):449-57.
Sandra M.G. Zwakhalen RN MSN, Katinka A.J. Van Dongen RN MSN, Jan P.H. Hamers PhD RN, Huda Huijer Abu-Saad PhD RNPain assessment in intellectually disabled people: non-verbal indicators J Adv Nurs. 2004 Feb;45(3):236-45.
Zwakhalen SM, van der Steen JT, Najim MD. Which score most likely represents pain on the observational PAINAD pain scale for patients with dementia? J Am Med Dir Assoc. 2012;13(4):384-9.
