Diagnostiek
Uitgangsvraag
Hoe kan een delier in de palliatieve fase en/of stervensfase gesignaleerd en gediagnosticeerd worden?
Methode: consensus-based
Aanbevelingen
- Onderzoek de mogelijkheid van een delier bij nieuw ontstane of veranderde symptomen, die binnen uren tot dagen ontstaan en kunnen passen bij een delier. Denk aan stoornissen op het gebied van waarneming, motoriek, emotie, slaap-waakritme, geheugen, denken, alertheid en veranderingen in het lichamelijk functioneren (zie Tabel 3 Signalen van een delier).
- Sluit een delier niet uit op één momentopname. Meerdere observaties op een dag kunnen nodig zijn voor het aantonen van een delier. Overweeg het gebruik van de DOS of DOM voor het screenen op - en monitoren van een delier.
- Stel de diagnose delier aan de hand van de DSM-5-TR criteria, eventueel met gebruikmaking van de CAM of 3-D-CAM. Betrek hierbij naasten en/of zorgverleners om een beeld te krijgen van het pre-morbide functioneren.
- Indien slechts één of twee kernsymptomen aanwezig zijn, neem dan preventieve maatregelen en blijf alert op lichamelijke problemen (dit kan een prodromale fase zijn van een zich ontwikkelend delier).
- Gebruik de DMSS als subtypering van een delier gewenst is. Zorg ervoor dat reversibele precipiterende factoren van (ernstig) lijden in kaart zijn gebracht.
- Schakel bij twijfel over de diagnose een deskundige in met specifieke expertise voor het diagnosticeren van een delier in de palliatieve fase.
- Consulteer laagdrempelig een expert (op het gebied van palliatieve zorg) in het eigen netwerk, of anders een intramuraal of regionaal consultatieteam palliatieve zorg voor deskundig advies (consultatiedienst palliatieve zorg landelijk en per regio).
Voor deze uitgangsvraag is geen systematisch literatuuronderzoek verricht.
Een delier wordt gediagnosticeerd door middel van observatie, anamnese indien mogelijk, en zeker ook met een heteroanamnese en cognitief onderzoek. Het lichamelijk en aanvullend onderzoek is van belang voor het opsporen van de lichamelijke oorzaak van een delier. Als voor aanvullend onderzoek een ziekenhuisbezoek noodzakelijk is, kan dit als belastend worden ervaren door de patiënt en de naasten. Het is daarom belangrijk alleen onderzoek te doen dat consequenties heeft voor het beleid in perspectief van de levensverwachting en behandelwensen. Het is van belang dit altijd met naasten en directe zorgverleners te bespreken. Bloedonderzoek is in de eerste lijn thuis goed mogelijk (echter veelal niet dezelfde dag).
Voor de diagnostiek van een delier in de palliatieve fase gelden de aanbevelingen zoals beschreven in de richtlijn Delier bij volwassenen en ouderen van de NVKG (2020). Diagnose op grond van DSM-5-TR (American Psychiatric Association 2022) criteria is van meerwaarde bij alle patiënten, ook bij patiënten met dementie [Sepulveda, 2016]. Aanvullende (fenomologische) signalen [Oh, 2017] (zie Tabel 4 Overzicht van aandachtspunten bij niet-medicamenteuze interventies) krijgen ook steeds meer een plaats in het proces van diagnosestelling [Watt, 2021]. Het is belangrijk dat het gaat over (sub)acute veranderingen van cognitieve symptomen.
Pathofysiologie en oorzaken
Er zijn nieuwere inzichten in de pathofysiologie: desintegratie van hersennetwerken met verminderde netwerkintegratie, verminderde efficiëntie en disfunctionele hersenknooppunten als common pathway van bijvoorbeeld ontstekingsprocessen, veranderingen in de balans van neurotransmitters of electrolytstoornissen.
Deze desintegratie is al aanwezig in de prodromale fase van een delier. Lichamelijke oorzaken kunnen een transitie naar een volledig delierbeeld veroorzaken. Vroegtijdige herkenning van de prodromale fase is belangrijk omdat er aanwijzingen zijn dat behandeling hiervan effect kan hebben op de gevolgen van een delierperiode.
Het hersennetwerk is dynamisch en flexibel en herconfigureert zich continu, afhankelijk van de processen die plaatsvinden, wat zich kan uiten in wisselende symptomen tijdens een delier. Cognitieve processen lijken (deels) afhankelijk te zijn van deze dynamische manier van functioneren en de flexibiliteit van het hersennetwerk [Van Monfort, 2019].
Nadat een patiënt klinisch gezien hersteld is, zijn er nog steeds complexe regionale veranderingen te vinden op hersenniveau. Mogelijk verklaart dit mede de verhoogde mortaliteit en cognitieve achteruitgang, welke ook nog na de delierperiode wordt gevonden.
Patiënten met meerdere predisponerende en precipiterende factoren hebben een verhoogd risico op het ontwikkelen van een delier. Hiervoor wordt het model van Inouye gebruikt (zie Figuur 2). Het is van belang om bij een delier deze factoren in kaart te brengen en zo mogelijk te behandelen (zie module Behandeling van veel voorkomende oorzaken van een delier).
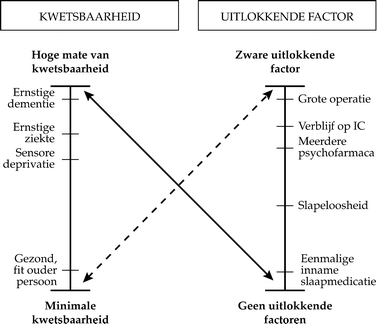
Figuur 2. Vrij gebaseerd op Model van Inouye [Inouye, 2014]
De volgende kenmerken zijn predisponerende factoren voor een delier:
- Leeftijd >70 jaar.
- Pre-existente cognitieve stoornissen zoals bij dementie of CVA.
- Visus- en gehoorstoornissen.
- Stoornissen in de activiteiten van het dagelijks leven (ADL).
- Gebruik van alcohol en opioïden.
- Polyfarmacie, vooral gebruik van anticholinerge middelen, opiaten en benzodiazepines (zie Tabel 2 Anticholinerge en andere delirogene geneesmiddelen).
Enkele voorbeelden van meest voorkomende precipiterende factoren in de palliatieve fase zijn:
- Pijn.
- Urineretentie.
- Infecties: pneumonie, urineweginfectie.
- Hersentumoren en -metastasen, meningitis carcinomatosa.
- Dehydratie.
- Obstipatie.
- Hypoxie.
- Anemie.
- Elektrolytstoornissen (m.n. hyponatriëmie, hypernatriëmie, hypercalciëmie).
- Hypoglykemie, hyperglykemie.
- Schildklierfunctiestoornissen.
- Leverfalen, nierfalen.
- Recente chirurgie.
- Medicatie: anticholinergica (zie Tabel 2 Anticholinerge en andere delirogene geneesmiddelen) opioïden en andere delirogene geneesmiddelen, een combinatie van deze middelen werkt tevens risico verhogend.
- Onttrekking van geneesmiddelen, nicotine of alcohol.
Diagnostiek in de prodromale fase
In de prodromale fase zijn slechts één of twee van de drie kernsymptomen van een delier aanwezig d.w.z. (1) veranderingen in de aandacht, veranderingen in het besef van de omgeving, (2) [sub]acuut van aard en/of (3) additionele veranderingen in cognitief functioneren [Boettger, 2018; Lawlor, 2014].
Extra alertheid is dan gewenst op:
- Signalen van een delier (zie Tabel 3 Signalen van een delier).
- Het ontstaan van de andere kernsympto(o)m(en).
- Het ontstaan van veel voorkomende lichamelijke oorzaken van een delier.
- Inzetten van (hulp)middelen voor het optimaliseren van sensore functies.
- De individuele behoeftes van de patiënt en de naasten.
- Met als doel een passende, veilige omgeving (zie Tabel 4 Overzicht van aandachtspunten bij niet-medicamenteuze interventies) te creëren [Inouye, 2014] en om (preventieve) interventies en behandeling van veel voorkomende oorzaken van een delier op tijd in te zetten.
| Stoornis | Voorbeelden |
|---|---|
| Perceptiestoornissen | Nieuw ontstane: • Hallucinaties • Illusionaire vervalsingen • Wanen • Oriëntatiestoornissen • Onrustige dromen |
| Motorische stoornissen (van hyperactieve en/of hypoactieve aard) | • Hyperactief: o Bewegingsdrang/loopdrang/dwalen o Schreeuwen o Kreunen o Plukken aan lakens o Trekken aan katheters, subcutane naaldjes, sondes en verbandmiddelen o Spierschokken o Stijfheid • Hypoactief: o Gemis aan gezichtsuitdrukking o Problemen in het starten van bewegingen en handelingen o Stiller/afwezig zijn • Mengvorm: o Wisselend beeld (on/off zijn) |
| Emotionele stoornissen | • Angst • Paniek • Somberheid • Boosheid • Agressie |
| Slaap-waakstoornissen | • Onrust in de avond/nacht • Omkering dag/nacht ritme |
| Stoornissen in de vorm van denken | • Denk aan tempo, coherentie en/of vloeiendheid |
| Stoornissen in het geheugen | • Stoornissen in het korte geheugen (bijvoorbeeld herhaling van korte cijferreeks lukt niet) |
| Stoornissen in alertheid - Sluit hierbij een comateus beeld uit |
• Alert, waakzaam • Slaperig • Moeilijk wekbaar |
| Veranderingen in het lichamelijk functioneren | • Tijdens de activiteiten van het dagelijks leven - ADL |
| Bij dementie: onbegrepen gedrag | • Met aandachtsstoornissen • Met perceptiestoornissen bv ineens partner niet meer herkennen • Geagiteerd gedrag • Verbale agitatie • Fysieke agitatie • Apathisch gedrag • Probleemgedrag ten gevolge van een delier wordt ALTIJD door een lichamelijke ziekte of aandoening veroorzaakt. |
Tabel 3 Signalen van een delier (pdf)
De transitie naar een volledig delierbeeld
De aanwezigheid van verschillende predisponerende factoren geeft standaard een hogere gevoeligheid (zoals hoge leeftijd en reeds aanwezige cognitieve stoornissen [Morandi, 2017] waardoor een enkele kleine precipiterende factor (zoals infectie, verhoging van anticholinerge medicatie of koorts) al een cascadereactie kan veroorzaken naar een volledig delierbeeld [van Montfort, 2019]. Omgekeerd kan bij een grote precipiterende factor (zoals intoxicatie) ook bij gezonde volwassenen en ouderen een delierbeeld ontstaan.
Diagnostiek van een delier
Bij diagnose van een delier zijn alle criteria van de DSM-5-TR van een delier aanwezig.
Centraal hierbij staan de 3 kernsymptomen van een delier:
De toegenomen stoornissen in de aandacht en in het besef van de omgeving.
- In alle gevallen (sub)acuut ontstaan en de neiging hebben te fluctueren.
- Andere toegenomen cognitieve veranderingen zoals geheugenproblemen, oriëntatieproblemen, taal- en visuospatiële functiestoornissen of perceptuele stoornissen.
De stoornisen zijn het fysiologische gevolg van een onderliggende somatische oorzaak.
Aanvullende symptomen (zoals emotionele stoornissen of slaapwaakstoornissen (zie Tabel 4 Overzicht van aandachtspunten bij niet-medicamenteuze interventies), die een signaalfunctie hebben voor een mogelijk delier, kunnen aanwezig zijn maar zijn niet absoluut noodzakelijk voor de diagnose.
Gezien het vaak fluctuerende beloop kan een momentopname onvoldoende zijn om een delier uit te sluiten.
Differentiaal diagnose
- Dementie: cognitieve achteruitgang is geleidelijker.
- Een ernstig gedaald bewustzijn, bijvoorbeeld een coma.
- Depressie: stemmingsproblemen staan meer op de voorgrond dan de cognitieve problemen.
- Andere psychiatrische aandoeningen (bv schizofrenie): cognitieve problemen staan minder op de voorgrond.
Het vermoeden op een (subtype) delier kan eerder gesteld worden door gebruik te maken van meetinstrumenten. Het meten van de ernst van een delier is belangrijk voor het objectiveren van het beloop van een delier.
Betrekken van de naasten
Voor een goede hetero-anamnese, en om een goed beeld te kunnen krijgen van het pre-morbide cognitieve functioneren, is het belangrijk om de naasten te betrekken bij diagnosestelling en beloop. Naasten vinden het belangrijk dat ze zelf een actieve rol hebben in het (h)erkennen van een delier en vervolgen van het effect van interventies tijdens een delier [Partridge, 2013; Racine, 2018].
Het vaststellen en geven van toelichting over ervaren discomfort van de patiënt of de naasten (al dan niet in het perspectief van eerdere ervaringen met een delier), discomfort/distress van affectieve aard en discomfort ten gevolge van fysieke klachten is belangrijk.
Over discomfort ten gevolge van fysieke klachten zoals pijn, misselijkheid en braken, dehydratie, jeuk, droge mond, obstipatie, zweten, honger, koude, slikproblemen, slaapproblemen en/of benauwdheid is veel bekend.
Discomfort van affectieve aard bij de patiënt, zoals het gevoel niet meer beter te worden, gek te worden, of vastgebonden te zijn, is net zo belangrijk om besproken te worden.
Maar ook naasten krijgen te maken met affectieve problemen tijdens een delierepisode. Bijvoorbeeld het niet meer herkend worden, het toegenomen verantwoordelijkheidsgevoel voor veilige en vertrouwde zorg en/of de angst voor mogelijk onvolledig herstel van de patiënt. Deze punten dienen zoveel mogelijk bespreekbaar gemaakt te worden om, indien mogelijk, gezamenlijk met de patiënt en naasten adequaat beleid te bepalen.
Lichamelijk onderzoek en aanvullend onderzoek
Het lichamelijk en aanvullend onderzoek zijn van belang voor het opsporen van behandelbare precipiterende factoren van een delier. Ingeschat wordt dat slechts in één kwart tot maximaal de helft van de delierperiodes deze reversibel is als de onderliggende precipiterende factor(en) wordt behandeld in de palliatieve fase, in de drie maanden direct voor de stervensfase [Leonard, 2008; De la Cruz, 2015]. Toch kan het de moeite waard zijn de uitlokkende factoren op te sporen, mits het onderzoek hiernaar niet als te belastend wordt ervaren.
Als voor aanvullend onderzoek ziekenhuisbezoek noodzakelijk is, kan dit als belastend worden ervaren door de patiënt en de naasten. Het is daarom belangrijk alleen onderzoek te doen dat consequenties heeft voor het beleid in perspectief van de levensverwachting en behandelwensen en dit met naasten en directe zorgverleners te bespreken. Bloedonderzoek is in de eerste lijn goed mogelijk (echter veelal niet dezelfde dag).
Observatieschalen en meetinstrumenten
Validiteitsstudies geven aan dat meetinstrumenten die waarschuwingssignalen bevatten meer valide zijn om een delier in de palliatieve fase te (h)erkennen [Sepulveda, 2016; Watt, 2021], zoals de Delier-o-meter (DOM) en de Delirium Observatie Screening (DOS) schaal. Beide instrumenten zijn oorspronkelijk voor een ander doeleinde ontwikkeld (de DOS voor screening, de DOM voor het meten van de ernst van een delier), maar bleken voor zowel screening als monitoring geschikt te zijn. Beide schalen hebben aandacht voor aandachtstoornissen, perceptuele stoornissen en oriëntatiestoornissen [Grover, 2012]. Symptomen van een delier zijn vaak wisselend aanwezig. Vaak wel in de avond of nacht maar niet overdag. (H)erkenning van observaties van zowel directe zorgverleners en naasten is hierbij van belang.
De Delirium Observatie Screening (DOS) Schaal [Schuurmans, 2003] is gebaseerd op observaties door verpleegkundigen bij patiënten met (verdenking op) een delier respectievelijk tijdens de dag-, avond- en nachtdienst. De observatie van twee van de drie kernsymptomen wordt in de DOS meegenomen (verminderde aandacht, afgenomen besef van de omgeving en cognitieve symptomen) [Oh, 2017]. De DOS is gevalideerd bij palliatieve patiënten [Detroyer, 2014].
De DOS kan gebruikt worden door verpleegkundigen en verzorgenden. Een voorwaarde is dat de verpleegkundige of verzorgende, die de screeningsschaal gebruikt, weet heeft van de premorbide neurocognitieve en neuropsychiatrische kernsymptomen van de patiënt, zodat veranderingen herkend kunnen worden. Het advies is om bij interpretatie van de uitslag niet een afkappunt te gebruiken, maar te vergelijken met voorgaande resultaten. Een relatieve verhoging van de score kan duiden op een delier en vormt l een aanleiding voor de regiebehandelaar om aan de hand van de DSM-5-TR criteria de diagnose delier te stellen. Een voordeel van de DOS is dat deze de mogelijkheid biedt om delierbehandelingen te evalueren.
De richtlijn Delier bij volwassenen en ouderen van de NVKG (2020) adviseert het gebruik van de DOS, voor zowel screening op - als monitoring van een delier, tenzij de a priori kans op een positieve screeningstest dusdanig groot is dat het zinvoller is om direct in te zetten op het diagnosticeren van een delier.
De Delier-O-Meter (DOM) [de Jonghe, 2005] is een soortgelijke observatieschaal voor verpleegkundigen en verzorgenden, die gevalideerd is voor de palliatieve zorg [van Trigt, 2018] en bij cognitieve stoornissen specifieker is dan de DOS voor de detectie van een delier en beoordeling van het beloop. Deze test hoeft niet op drie momenten in 24 uur te worden afgenomen. In de tekst wordt expliciet gevraagd naar mogelijke fluctuaties. De DOM is getest in de eerste lijn in de palliatieve fase. Een nadeel van de DOM is dat deze minder expliciet vraagt naar geheugenproblemen.
Hulpmiddel (algoritme) naar de diagnose toe
De CAM (Confusion Assessment Method) en de kortere 3D-CAM (brief cognitive screen with CAM) versie is een door een groep van experts ontwikkelde beslisboom om bij neuropsychiatrische symptomen de mogelijkheid van een delier vast te stellen. Weging van de cognitieve veranderingen en het zoeken van de oorza(a)k(en) moet dan nog plaatsvinden om de uiteindelijke diagnose te kunnen stellen door ter zake deskundigen [Inouye, 1990; Vreeswijk, 2009]. De CAM is gevalideerd voor de palliatieve zorg setting [Ryan, 2009].
Subtypering van een delier
Om subtypes van een delier te onderscheiden in de palliatieve fase kunnen verschillende methoden worden gebruikt. Het is van belang om naasten en zorgverleners over het subtype te informeren.
Als meetinstrument kan de DMSS (Delirium Motor Subtype Scale) worden gebruikt [Slor, 2014], welke is gevalideerd in Nederland. De DSM-5-TR maakt bij het delier onderscheid in een aantal subtypes waaronder het hyperactieve, hypoactieve (stil) en gemengd delier (zie richtlijn Delier bij volwassenen en ouderen NVKG (2020)).
De symptomen van een hyperactief delier worden meestal wel onderkend, maar een hypoactief (stil) delier kan geduid worden als depressie of vermoeidheid. Door de minder opvallende symptomen wordt een hypoactief delier makkelijker gemist.
I. Hyperactief delier
De DSM-5-TR stelt dat bij een hyperactief delier:
- De psychomotorische activiteit van de betrokkene sterk toegenomen is (versneld en veel praten, uitbundige ondersteunde lichaamsgebaren, hoge polsfrequentie of snelle ademhaling).
- Dit kan samengaan met stemmingslabiliteit, verhoogde alertheid, agitatie en/of weigering om aan de behandeling mee te werken.
II. Hypoactief delier, ook wel stil of apathisch delier genoemd
Slaperigheid en inactiviteit overheersen het klinisch beeld van een hypoactief delier [Hosker, 2017]. Een betrouwbare hetero-anamnese is nodig om te bepalen of deze symptomen pre-existent waren (dan zijn deze eerder verdacht voor bijvoorbeeld een dementie of een depressie) of pas enkele uren of dagen bestaan en een fluctuerend beloop hebben.
De DSM-5-TR stelt dat bij een hypoactief delier de psychomotorische activiteit sterk verminderd is en kan samengaan met verminderde alertheid, traagheid en lethargie totdat deze bijna stuporeus is.
III. Gemengd delier
Hiervan is sprake bij het afwisselend optreden van hyperactieve en hypoactieve deliersymptomen. De DSM-5-TR stelt dat bij een gemengd activiteitsniveau de mate van psychomotorische activiteit van de betrokkene snel fluctueert. Ook kan sprake zijn van een gemengd delier wanneer het activiteitsniveau normaal is, maar bewustzijn en aandacht wisselend gestoord zijn.
Het lijkt niet uitgesloten dat m.n. de hypoactieve delieren een slechtere prognose kunnen vertonen [Meagher, 2011; Gual, 2018], wat zou kunnen suggereren dat hyperactiviteit mogelijk een beschermend effect heeft op het verloop en de prognose. Het gebruik van de DMSS of de kortere DMSS-4 [Meagher, 2014] als meetinstrument voor subtypering (nadat de diagnose delier is gesteld) zou om deze reden de moeite waard kunnen zijn om in te zetten voor monitoring en informatie over de prognose op kortere termijn.
Gezien het belang van het onderscheid voor de behandeling en de complexe diagnostiek, dient er bij twijfel een expert te worden ingeschakeld. De huidige diagnostische tools voor bijvoorbeeld pijn en discomfort zijn onvoldoende onderscheidend. Goede diagnostische tools zijn in ontwikkeling maar tot nu toe onvoldoende gevalideerd voor palliatieve zorg settingen [van der Steen, 2015; Racine, 2018].
Consultatie
Consultatie van een expertteam in het eigen regionale netwerk voor patiënten in de palliatieve fase, kan een positieve impact hebben op de kwaliteit van zorg [Hui, 2014] en tevens kostenbesparend zijn [Maetens, 2019]. In de thuissituatie kan (een eenmalige) consultatie en/of (gedeeltelijke) overname van in regio passende palliatieve (delier)zorg via de huisarts van de specialist ouderengeneeskunde, arts verstandelijk gehandicapten, gedragswetenschapper of verpleegkundig specialist gefinancierd worden via geneeskundige zorg voor specifieke patiëntgroepen (GZSP) gelden via de Zorgverzekeringswet (Zvw). De SO, AVG-arts, gedragswetenschapper of verpleegkundig specialist als regiebehandelaar kan in dat geval een integraal behandelplan opstellen, waarin ook paramedische zorg of behandeling in een groep kan worden opgenomen. Sommige regio’s zijn verder dan andere regio’s in het bepalen wat passende zorg is en hoe zorg en behandeling in de Avond Nacht en Weekend (ANW) diensten afgestemd kunnen worden.
In het ziekenhuis kan het delierteam, geriatrieteam of palliatieve team geconsulteerd worden voor palliatieve zorg, wat bij patiënten in de palliatieve fase tot een verbetering van de kwaliteit van leven kan leiden [Vanbutsele, 2018]. Indien een dergelijk team niet aanwezig is, en de hulpverlener behoefte heeft aan deskundig advies, kan het regionaal consultatieteam palliatieve zorg geconsulteerd worden (consultatiedienst palliatieve zorg landelijk en per regio).
