Medicamenteus beleid in de palliatieve fase
Uitgangsvraag
Wat is het medicamenteuze beleid ter behandeling van een delier in de palliatieve fase?
Methode: evidence-based
Aanbevelingen
- Zet altijd eerst in op niet-medicamenteuze interventies (zie module Preventie).
- Stel vast dat niet-medicamenteuze behandeling en/of behandeling van de onderliggende oorzaak van het delier onvoldoende effect heeft. Of dat er sprake is van discomfort (zie module Diagnostiek).
- Behandel medicamenteus bij psychotische kenmerken en/of ernstige onrust.
- Gebruik haloperidol als eerste keuze voor medicamenteuze behandeling, behalve bij:
- Patiënten met de ziekte van Parkinson/hypokinetisch rigide syndroom.
- Patiënten met Lewy body dementie.
- Behandel met laagst mogelijke dosering haloperidol (zie Tabel 7 Overzicht van geadviseerde doseringen in module 6. Dosering en toedieningsvormen).
- Overweeg risperidon als alternatief voor haloperidol.
- Bij patiënten met ziekte van Parkinson, hypokinetisch rigide syndroom of Lewy Body Dementie:
- Overleg met neuroloog/geriater/specialist ouderengeneeskunde met ervaring met deze doelgroep, over de mogelijkheid om dopaminerge medicatie te verlagen.
- Start met clozapine. Pas de dosering aan afhankelijk van leeftijd en co-morbiditeit (zie Tabel 7 Overzicht van geadviseerde doseringen in module 6 Dosering en toedieningsvormen).
- Overweeg behandeling met quetiapine bij contra-indicatie voor clozapine.
- Overweeg behandeling met rivastigmine bij onvoldoende effect en/of bijwerkingen van clozapine en quetiapine.
- Overweeg een kortwerkend benzodiazepine (midazolam) als andere behandelingen onvoldoende effectief zijn en/of bij heftige angst/agitatie. Bij onvoldoende effect van midazolam of eerdere goede ervaringen kan ook het langer werkende lorazepam of oxazepam worden toegediend (zie Tabel 8 Overzicht van behandelopties voor orale toediening in module 6 voor mogelijkheden van toediening).
- Gebruik benzodiazepines (lorazepam of oxazepam) bij een onttrekkingsdelier (plots staken van benzodiazepines, alcohol of drugs), in geval van nood bij heel ernstige agitatie met motorische onrust en/of hevige angst en/of katatone symptomen (onder andere spierstijfheid) (zie module onttrekkingsdelier in de richtlijn Delier bij volwassenen en ouderen).
- Houd rekening met interactie met andere medicatie. Het gebruik van levomepromazine (Nozinan) is in principe beperkt tot de palliatieve sedatie fase. Bij moeilijk behandelbare klachten zoals slaapproblemen en braken/misselijkheid kan levomepromazine een additionele mogelijkheid zijn (zie ook richtlijn Misselijkheid en braken).
- Monitor het beloop van het delier en alle bijwerkingen zoals bijvoorbeeld extrapiramidale symptomen bij gebruik van antipsychotische medicatie of toename verwardheid bij gebruik benzodiazepines.
- Verlaag en stop de (anti-psychotische) medicatie bij opknappen van het delier (zie Tabel 7 Overzicht van geadviseerde doseringen in module 6. Dosering en toedieningsvormen).
- Soms kan behandeling met rivastigmine worden overwogen, raadpleeg hiervoor altijd een expert.
- Consulteer bij onvoldoende effect/vragen laagdrempelig een expert (op het gebied van palliatieve zorg) in het eigen netwerk, of anders een intramuraal of regionaal consultatieteam palliatieve zorg voor deskundig advies (consultatiedienst palliatieve zorg landelijk en per regio).
- Raadpleeg Tabel 7 voor een overzicht van geadviseerde doseringen. Tabel 8 voor orale doseringen en Tabel 9 wanneer slikken niet meer lukt.
Onderbouwing
Om de uitgangsvraag van deze module te beantwoorden is een systematische analyse van de literatuur gedaan. De onderzoeksvraag die hiervoor is onderzocht is PICO-gestructureerd en luidt:
Wat zijn de (on)gunstige effecten van medicamenteuze behandelingen (haloperidol en rivastigmine) bij patiënten in de palliatieve fase die een delier doormaken?
De palliatieve fase wordt in de literatuur zelden duidelijk gemarkeerd conform het Kwaliteitskader palliatieve zorg NL [IKNL/Palliactief, 2017]. Daarom is in deze analyse zowel literatuur geïncludeerd over patiënten in de palliatieve fase als ernstig zieke patiënten. Laatstgenoemde categorie wordt geincludeerd als indirect bewijs omdat het niet per definitie patiënten in de palliatieve betreft.
Zoeken naar wetenschappelijk bewijs
Voor deze vraag is gebruikt gemaakt van de Cochrane review van Finucane et al. [Finucane, 2020]. Deze review is geüpdatet. Op 29 maart 2021 is in de databases Medline, Embase en de Cochrane Library gezocht naar wetenschappelijke literatuur. De zoekactie leverde na ontdubbelen 882 resultaten op. De selectiecriteria en de volledige zoekactie is beschreven in bijlage 1. De selectiecriteria zijn toegepast op de referenties verkregen uit de zoekactie. In eerste instantie zijn de titel en abstract beoordeeld. Er zijn 29 referenties geïncludeerd. Hiervan werden de volledige artikelen opgezocht en beoordeeld. Hierna zijn 26 referenties geëxcludeerd en drie studies geïncludeerd [van der Vorst, 2020; Barbateskovic, 2020; van Eijk, 2010]. De studies hadden betrekking op behandeling met haloperidol. Er zijn geen studies geïdentificeerd waarin rivastigmine is onderzocht. In de exclusietabel in bijlage 2 is de reden voor exclusie van de 26 referenties toegelicht.
Resultaten
Beschrijving van de studies
In onderstaande tekst wordt een beschrijving gegeven van de geïncludeerde studies.
Finucane et al. (2020) voerden een systematische review uit om uit te zoeken wat er bekend is over de effectiviteit en bijwerkingen van geneesmiddelen bij de behandeling van delier bij volwassenen met een terminale ziekte [Finucane, 2020]. Terminale ziekte was gedefinieerd als elke patiënt met een gevorderde progressieve ziekte zoals vergevorderde kanker, vergevorderde dementie of orgaanfalen. Ook studies die personen in een hospice of personen die levenseindezorg ontvingen onderzochten, kwamen in aanmerking voor deze review. In de systematische review werden in totaal vier gerandomiseerde studies geïncludeerd, met in totaal 399 patiënten. De meeste patiënten hadden ofwel kanker ofwel AIDS [Agar, 2017; Breitbart, 1996; Hui, 2017; Lin, 2008]. De onderzochte geneesmiddelen waren antipsychotica (drie onderzoeken) en benzodiazepines (één onderzoek). In deze studie waren de symptomen van delier, agitatie en bijwerkingen als uitkomstmaten onderzocht.
Barbateskovic et al. 2019 voerden een systematische review uit om de voor- en nadelen te beoordelen van haloperidol versus placebo of een andere interventie voor de behandeling van delier bij ernstig zieke patiënten [Barbateskovic, 2020]. Ernstige zieke patiënten zijn gedefinieerd als patiënten met een hoog risico om te overlijden of met een (mogelijk) levensbedreigende ziekte. Ze zijn opgenomen op een afdeling met hoog geconcentreerde zorg, zoals een intensive care afdeling, of hartafdeling van een ziekenhuis. Ook patiënten die acute chirurgie of electieve hartchirurgie kregen, zijn meegenomen. In de systematische review zijn acht studies geïncludeerd [Atalan, 2013; Bakri, 2015; Breitbart, 1996; Girard, 2018; ORIC-I, n.d.; Han, 2004; Skrobik, 2004; Tagarakis, 2012]. Daarin worden elf vergelijkingen gemaakt. Alle onderzoeken omvatten ernstig zieke volwassen patiënten. Vijf onderzoeken omvatten volwassenen die waren opgenomen op een ICU [Bakri, 2015; Girard, 2018; Han, 2004; ORIC-I, n.d.; Skrobik, 2004], twee onderzoeken omvatten hartchirurgische patiënten [Atalan, 2013; Tagarakis, 2012] en één onderzoek omvatte patiënten met AIDS [Breitbart et al. 1996]. Het aantal deelnemers aan de onderzoeken varieerde van 24 tot 566. De gemiddelde leeftijd van de deelnemers varieerde van 31 jaar tot 71 jaar en het aandeel mannen varieerde tussen 54% en 91% in de opgenomen onderzoeken. De studie van Breitbart et al. [Breitbart, 1996] is geïncludeerd in beide systematische reviews [Finucane, 2020; Barbateskovic, 2020].
Agar et al. publiceerden in 2017 een onderzoek waarin 247 patiënten zijn onderzocht in Australië. 88% van de patiënten had kanker. Patiënten werden na diagnose gerandomiseerd naar een behandeling met risperidon of haloperidol of placebobehandeling. Ondanks de randomisatie was er verschil in mediane dosering opioiden: risperidon = 6,9 (IQR: 0,88 tot 2,0); haloperidol = 33,0 (0 tot 153,5); placebo = 15,0 (0 tot 86,4). Patiënten van 65 jaar of jonger kregen een opstartdosis van 0,5 mg oraal toegediend samen met de eerste dosis van 0,5 mg, daarna 0,5 mg onderhoudsdoses om de 12 uur. Doses konden worden getitreerd met 0,25 mg op dag 1 en daarna met 0,5 mg tot een maximale dosis van 4 mg dd. Voor deelnemers ouder dan 65 jaar werden de opstart-, begin- en maximumdoses gehalveerd. De placebo-oplossing werd op dezelfde manier getitreerd met behulp van overeenkomende volumes oplossing voor elk dosisniveau. Niet-medicamenteuze interventies werden gegeven zodra de medicamenteuze interventies waren gestart, dus niet voorafgaand. Alle deelnemers ontvingen geïndividualiseerde behandelplannen, inclusief behandeling van reversibele precipiterende en onderhoudende factoren en niet-farmacologische maatregelen (hydratatie, zicht- en gehoorapparaten, aanwezigheid van familie en heroriëntatie). Patiënten werden zes maanden gevolgd.
Breitbart et al. onderzochten 30 patiënten met AIDS in de Verenigde Staten. Behandeling met haloperidol, chloorpromazine of lorazepam werd toegepast volgens een protocol afhankelijk van de ernst van het delier. Elk uur werd gemeten met de Delirium Rating Scale. Wanneer een patiënt 13 of hoger scoorde werd de dosering verhoogd volgens onderstaande tabel.
Tabel 6. Medicatieschema toegepast in de studie van Breitbart et al. 1996
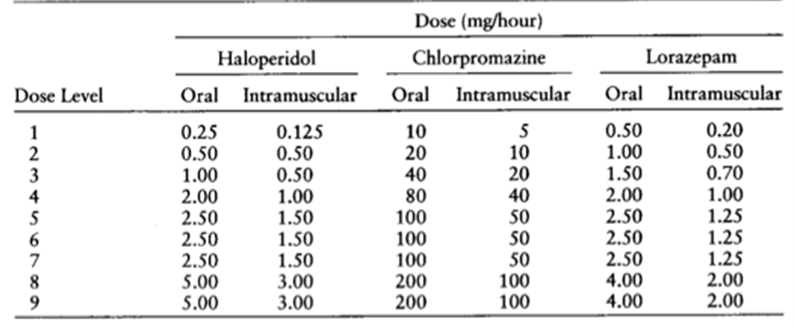
Tabel 6. Medicatieschema toegepast in de studie van Breitbart et al. 1996 (pdf).
Hui et al. onderzochten 58 patiënten in de Verenigde Staten met kanker. Alle patiënten startten onmiddellijk een gestandaardiseerd open-label regime met haloperidol (2 mg) elke 4 uur intraveneus en nog eens 2 mg elk uur indien nodig voor agitatie. Klachten van elke patiënt werden elke twee uur beoordeeld met de Richmond Agitation-Sedation Scale (RASS) score totdat de score 2 of meer was en noodmedicatie nodig was volgens het oordeel van de verpleegkundige. Zodra de patiënt deze drempel had bereikt, werd een enkele dosis van 3 mg lorazepam in 25 ml 0,9% normale zoutoplossing of identiek lijkende placebo (25 ml 0,9% normale zoutoplossing) intraveneus toegediend gedurende 1,5 minuut. Patiënten in de studie werden in totaal acht uur gevolgd.
Lin et al. onderzochten 30 patiënten in Taiwan met kanker. Patiënten werden gerandomiseerd in een olanzapinegroep of een haloperidolgroep, met een startdosering van 5 mg olanzapine (oraal) per dag om 18:00 uur of haloperidol 5 mg per dag om 18:00 uur via orale toediening gedurende zeven dagen. De doseringen werden getitreerd door de psychiater. De maximale doses waren 15 mg olanzapine per dag en 15 mg haloperidol (oraal) per dag. Wanneer de patiënten een aanvullende psychotrope therapie nodig hadden voor acute symptomen, kregen ze zo nodig midazolam via een intramusculaire injectie.
Atalan et al. onderzochten 53 patiënten met hyperactief delier na een hartoperatie opgenomen op IC. Patiënten kregen elk uur 5 mg haloperidol IM of 5 mg morfine IM totdat de adequate sedatie en de beoogde RASS-scores (tussen −1 en + 1) waren bereikt. De behandeling werd maximaal tien dagen toegepast en werd eerder gestopt bij voldoende effect.
Bakri et al onderzochten 48 post-operatieve traumapatiënten met een delier en opgenomen op IC. Patiënten werden gerandomiseerd naar 5 mg haloperidol tweemaal daags (intraveneus) of 1 μg/kg dexmedetomidine of (intraveneus) of 4 mg ondansetron tweemaal daags (intraveneus) gedurende drie dagen. Escape medicatie (haloperidol) kon worden gebruikt.
Girard et al. onderzochten 280 patiënten met delier die waren opgenomen op de IC. Zij randomiseerde patiënten naar haloperidol (IV) of ziprasidon (IV). De gemiddelde dagelijkse dosis haloperidol die werde toegediend was 11mg. De gemiddelde dagelijkse dosis ziprasidon die werd toegediend was 20mg of placebo gedurende veertien dagen.
Han et al. onderzochten 24 patiënten met delier die waren opgenomen op de IC. Patiënten kregen een flexibele orale dosis haloperidol of risperidon. De aanvangsdosis van elk middel was tweemaal daags 0,75 mg (haloperidol) of 0,5 mg (risperidon). De dosering werd verhoogd afhankelijk van de status van delier gedurende zeven dagen. De gemiddelde dosis haloperidol was 1,71 mg en van risperidon 1,02.
ORIC-I onderzochten 29 invasief beademde patiënten met delier. Patiënten kregen 5 mg IV haloperidol elke 12 uur of placebo gedurende vijf dagen. Patiënten werden gevolgd tot mechanische ventilatie niet meer nodig was of na 28 dagen, afhankelijk van wat zich het eerst voordeed.
Skrobik et al. onderzochten 73 patiënten met delier opgenomen op een medisch-chirurgische IC. Patiënten kregen haloperidol oraal of via maagsonde. Aanvankelijk startten zij met 2,5 tot 5 mg om de 8 uur (patiënten ouder dan 60 kregen een lagere aanvangsdosis haloperidol 0,5-1 mg). De controlegroep kreeg enteraal of oraal olanzapine. Zij startten met dosering van 5 mg per dag. Patiënten ouder dan 60 kregen een lagere aanvangsdosis olanzapine 2,5 mg. Patiënten in de haloperidolgroep kregen een gemiddelde dagelijkse dosis van 6,5 mg haloperidol (spreiding 1-28 mg) vergeleken met 4,54 mg voor de olanzapinegroep (spreiding 2,5-13,5 mg). De behandeling duurde vijf dagen.
Tagrakis et al. onderzochten 80 patiënten met delier na hartchirurgie. Patiënten werden gerandomiseerd naar 5 mg IV-haloperidol of 8 mg IV ondansetron. De behandeling werd maximaal zeven dagen toegepast en werd eerder gestopt bij voldoende effect.
Naast de reviews werd een primaire studie van Van der Vorst et al. uit 2020 toegevoegd [van der Vorst, 2020]. Deze RCT is gepubliceerd na de zoekdatum van de systematische reviews. Het betreft onderzoek naar de voor- en nadelen van olanzapine en haloperidol ter behandeling van delier bij patiënten met vergevorderde kanker opgenomen in een ziekenhuis of in een hospice. Aan het onderzoek, uitgevoerd in Nederland, deden 98 patiënten mee. De mediane dosis olanzapine was 8,8 mg (IQR, 5,0-15,0 mg) op dag 1, 5,0 mg (IQR, 0,0-10,0 mg) op dag 2 en 5,0 mg (IQR, 1,9-10,0 mg) aan het einde van de studie. De mediane dosis haloperidol was 2,5 mg (1,0-4,8 mg) op dag 1, 1,3 mg (IQR 0,5-2,9 mg) op dag 2 en 1,8 mg (IQR 0,5-2,8 mg) aan het einde van de studie.
Haloperidol versus placebo
Agar et al. onderzochten de effectiviteit van haloperidol ten opzichte van een placebobehandeling [Agar, 2017]. Zij vonden een voordeel van placebo ten opzichte van haloperidol bij patiënten met een mild tot matig delier. Symptomen van delier werden onderzocht door 3 van de 5 items van de Nursing Delirium Screening Scale te beoordelen. Patiënten in de placebogroep scoorden gemiddeld 0,34 lager na 24 uur (95%BI -0,07 tot 0,75) en 0,49 tussen 24 en 48 uur (95%BI 0,10 tot 0,88).
Bewijskracht
De bewijskracht van de effectiviteit van haloperidol versus placebo begon als hoog omdat het afkomstig is uit RCT. De bewijskracht is met twee niveaus verlaagd vanwege het risico op bias. Een groot aantal patiënten viel uit en het meetinstrument is aangepast omdat de aanpassing niet gevalideerd is. Daarnaast kreeg de haloperidongroep ook meer opioï den dan de placebogroep. Mogelijk had dit effect op de uitkomstmaat. Ook is bewijskracht verlaagd vanwege onnauwkeurigheid; de sample size van de studie was onvoldoende. De bewijskracht kwam zodoende uit op zeer laag.
Haloperidol versus risperidon
Agar et al. onderzochten naast een placebobehandeling ook risperidon [Agar, 2017]. Er werd geen statistisch significant verschil gemeten tussen haloperidol en risperidon met betrekking tot het effect op de Delirium Symptom Score na 24 uur (MD= -0,42; 95%BI -0,90 tot 0,06) en 48 uur (MD= -0,36; 95%BI -0,92 tot 0,20).
Bewijskracht
De bewijskracht voor de effectiviteit van haloperidol versus risperidon begon als hoog omdat de resultaten afkomstig zijn uit een RCT. De bewijskracht is met een niveau verlaagd vanwege risk of bias. Een groot aantal patiënten viel uit en het meetinstrument is aangepast terwijl de aanpassing niet gevalideerd is. Daarnaast is de bewijskracht verlaagd vanwege onnauwkeurigheid, de sample size van de studie was onvoldoende en de gegevens sluiten een voordeel van beide behandelingen niet uit. De bewijskracht kwam zodoende uit op laag.
Haloperidol versus olanzapine
In twee studies werd het effect na 24 uur gemeten [van der Vorst, 2020; Lin, 2008]. De resultaten kunnen niet gecombineerd worden tot een gezamenlijk resultaat omdat de uitkomsten absoluut (continu) en als verschil (dichotoom) zijn gepresenteerd. Beide studies konden geen verschil tussen de behandelingen aantonen.
Lin et al. vonden een gemiddeld verschil van 2,36 op de Delirium Rating Scale (95%BI -0,75 tot 5.47). Tussen 24 en 48 uur was dit 1,9 (95%BI -1,5 tot 5,3). Van der Vorst et al. onderzochten de Delirium Response Rate (DDR). De DRR was 45% voor olanzapine (95% BI, 31-59) en 57% (95% BI, 43-71) voor haloperidol (ΔDRR = -12%; OR=0,61; 95% BI 0,2 tot 1,4) in de intention-to-treat analyse. Bij subgroepanalyse werden geen verschillen gezien tussen de effecten van beide middelen bij patiënten met een hyperactief delier of een stil delier.
Van der Vorst et al. onderzochten ook de gemiddelde tijd tot response. Dit was in de haloperidol-arm 2,8 dagen (95% BI 1,9 tot 3,7) en in de olanzapine-arm 4,5 dagen (95% BI 3,2 tot 5,9).
Een aanvullende analyse liet geen significant voordeel zien van olanzapine bij DRR voor hyperactieve, hypoactieve of gemengde subtypes.
Bewijskracht
De bewijskracht van de uitkomstmaat effectiviteit voor haloperidol versus olanzapine begon als hoog omdat het afkomstig is uit RCT’s. De bewijskracht is met een niveau verlaagd vanwege het risico op bias. Daarnaast is het met twee niveaus verlaagd vanwege onnauwkeurigheid; het is onduidelijk welke interventie het meest effectief is. De bewijskracht kwam zodoende uit op zeer laag.
Bijwerkingen
In de review van Barbateskovic, 2019 waren vier onderzoeken die het aantal patiënten met ernstige bijwerkingen rapporteerden [ORIC-I, n.d.; Atalan, 2013; Bakri, 2015; Han and Kim, 2004]. Zij vonden geen verschil in bijwerkingen tussen de behandelarmen.
De review van Finucane et al. rapporteerde bijwerkingen per vergelijking. In de studie van Agar werden statistisch significant meer bijwerkingen gevonden in de studiearm met haloperidol dan in de placebo-arm (MD=0,79; 95% BI 0,17 tot 1,41) [Agar, 2017]. De overige studies vonden geen verschil in bijwerkingen tussen de behandelarmen [Hui, 2017; Lin, 2008].
Ook Van der Vorst et al. vonden geen verschil. Bijwerkingen gerelateerd aan de behandeling kwamen bij 16 patiënten (32,7%) voor in de haloperidol-arm en 13 patiënten (26,5%) in de olanzapine-arm (RR=1,17; 95% BI 0,62 tot 2,24). Ernstige bijwerkingen die leidden tot stopzetting van het geneesmiddel werden gemeld bij tien patiënten (20,4%) in de haloperidol-arm en bij vijf patiënten (10,2%) in de olanzapine-arm (RR=1,83; 95% BI 0,67 tot 5,01). Het ging om sedatie, extrapiramidale bijwerkingen (EPS) (inclusief tremoren en spierstijfheid), QTc-verlenging (> 500 msec). Alle ernstige bijwerkingen traden op, op dag 1 of 2. Er waren geen sterfgevallen gerelateerd aan de behandeling in beide behandelarmen.
Bewijskracht
De bewijskracht voor de uitkomstmaat bijwerkingen van haloperidol begon als hoog omdat het afkomstig is uit RCT’s. De bewijskracht is met een niveau verlaagd vanwege inconsistentie; de resultaten komen uit studies waarin verschillende vergelijkingen, patiënten en ernstige bijwerkingen zijn onderzocht. Daarnaast is de bewijskracht met een niveau verlaagd vanwege onnauwkeurigheid, de optimal information size is voor deze uitkomstmaat niet gehaald. Het is aannemelijk dat niet alle patiënten in de studies pallatieve zorg kregen. De uitkomsten van indirect bewijs waren echter niet anders dan direct bewijs. Zodoende is de bewijskracht niet voor indirectheid verlaagd. De bewijskracht kwam zodoende uit op zeer laag.
Cognitieve status
De studie van Breitbart et al. rapporteert over cognitieve functie gemeten met de Mini-Mental State. De gemiddelde scores aan het einde van de interventie waren: haloperidolgroep 17,18 (±12,12), chloorpromazinegroep 15,05 (±10,43) en lorazepam 11,50 (±8,69). Het verschil was niet statistisch significant verschillend.
Bewijskracht
De bewijskracht begon als hoog omdat het afkomstig is uit RCT’s. De bewijskracht is met een niveau verlaagd vanwege beperkingen in de studieopzet. De allocatie van de behandeling was onduidelijk. Ook is de bewijskracht met twee niveaus verlaagd vanwege onnauwkeurigheid; er zijn 19 en 11 patiënten onderzocht. De bewijskracht kwam zodoende uit op zeer laag.
Kwaliteit van leven
De studie van Van der Vorst et al. onderzocht delier gerelateerde stress voor patiënten en mantelzorgers bij toepassing van haloperidol en olanzapine [van der Vorst, 2020]. Zestien patiënten in elke behandelarm voltooiden de Delirium Experience Questionnaire. Het gemiddelde deliriumgerelateerde distressniveau of angstniveau op een schaal van 0 tot 4) was 2,1 (SD 1,4) in de olanzapine-arm en 2,3 (SD 1,4) in de haloperidol-arm (MD=0,2; 95%BI -0,8 tot 1,2). De DEQ werd ook ingevuld door echtgenoten en/of zorgverleners en door de behandelende verpleegkundigen. In geen van de groepen werd een verschil gezien tussen haloperidol en olanzapine.
Bewijskracht
De bewijskracht begon als hoog omdat het afkomstig is uit RCT’s. De bewijskracht is met een niveau verlaagd vanwege indirectheid; er is geen formele kwaliteit van leven vragenlijst gebruikt. Daarnaast is de bewijskracht verlaagd vanwege onnauwkeurigheid; er zijn 98 patiënten onderzocht en er kon geen klinisch relevant verschil worden aangetoond. Het bewijs is indirect omdat patiënten niet specifiek palliatieve zorg krijgen. De bewijskracht kwam zodoende uit op zeer laag.
Mortaliteit
In de review van Barbateskovic, 2020 waren vier studies (zes vergelijkingen) die mortaliteit onderzochten [Atalan, 2013; Breitbart, 1996; Girard, 2018; ORIC-I, n.d]. De gemiddelde follow-up was 34 dagen (variërend van 8 tot 90 dagen). Een meta-analyse van de studies kon geen effect aantonen of uitsluiten (RR=1,01; 95%BI 0,33 tot 3,06).
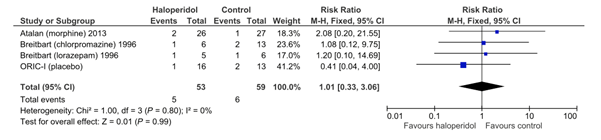_richtlijn_Delier_2022.png)
Figuur 3. Meta-analyse voor de uitkomstmaat mortaliteit (alle oorzaken)
Figuur 3. Meta-analyse voor de uitkomstmaat mortaliteit (alle oorzaken) (pdf)
Bewijskracht
De bewijskracht begon als hoog omdat het afkomstig is uit RCT’s. De bewijskracht is met twee niveaus verlaagd vanwege het risico op bias. Daarnaast is de bewijskracht verlaagd vanwege onnauwkeurigheid; er kon geen klinisch relevant verschil worden aangetoond of worden uitgesloten. De bewijskracht kwam zodoende uit op zeer laag.
Rivastigmine + haloperidol versus placebo + haloperidol
Van Eijck et al. hadden een steekproefomvang van 440 patiënten gepland [van Eijk, 2010]. Echter werd na inclusie van 109 patiënten geadviseerd de studie te stoppen, omdat de mortaliteit in de rivastigminegroep (n=12, 22%) hoger was dan in de placebogroep (n=4, 8%; p=0,07). De duur van delier was langer in de rivastigminegroep dan in de placebogroep, maar het verschil was niet statistisch significant (5,0 dagen, IQR 2,7-14,2) vergeleken met de placebogroep (3,0 dagen, IQR 1,0-9,3; p=0,06). Bovendien hadden patiënten in de rivastigminegroep significant meer klachten van het delier dan in de placebogroep. Vergeleken met patiënten in de placebogroep kregen patiënten in de rivastigminegroep gemiddeld meer haloperidol, lorazepam en propofol, en bleven significant langer op de intensive care en lagen significant langer in coma. De hazard ratio (HR) voor delierduur geassocieerd met het gebruik van rivastigmine was 0,72 (95% BI 0,44 tot 1,17). Meer patiënten in de rivastigminegroep overleden (n=12, 22%) dan in de placebogroep (n=4, 8%; p=0,07).
Bewijskracht
De bewijskracht begon als hoog omdat het afkomstig is uit RCT. De bewijskracht is met twee niveaus verlaagd vanwege onnauwkeurigheid, de optimal information size was niet gehaald; er kon geen klinisch relevant verschil worden aangetoond. Het bewijs is indirect omdat patiënten niet niet specifiek palliatieve zorg krijgen. De bewijskracht kwam zodoende uit op zeer laag.
Overige uitkomstmaten
Resultaten over gebruik van escape medicatie, functionele status en kwaliteit van sterven zijn niet beschreven.
Onderstaande vergelijkingen zijn ook in de reviews gevonden. Deze middelen waren echter niet geprioriteerd in de knelpuntenanalyse. De resultaten zijn opgenomen als achtergrond omdat er in de aanbevelingen wel over geschreven wordt. Omdat het geen systematische analyse van de literatuur betreft zijn geen GRADE-conclusies geformuleerd.
Risperidon versus placebo
Agar et al. lieten zien dat risperidon mogelijk voor een verslechtering zorgt van symptomen van delier vergeleken met placebo na 24 uur (MD=0,76; 95%BI 0,30 tot 1,22) en na 48 uur (MD=0,85; 95%BI 0,32 tot 1,38). Er werd geen verschil gevonden in het effect op agitatie (MD -0,05; 95%BI -0,19 tot 0,09). Wel gaf risperidon vaker extrapiramidale bijwerkingen dan de placebo (MD 0,73; 95%BI 0,09 tot 1,37).
Lorazepam versus chloorpromazine
Breitbart et al. onderzochten de effectiviteit van lorazepam versus chloorpromazine. Zij konden geen verschil aantonen tussen beide behandelingen op symptomen van delier na 48 uur (MD= 5,25; 95%BI 0,38 tot 10,12). Bijwerkingen lijken wel meer voor te komen. Er werd een statistisch significant verschil gevonden bij gebruik van lorazepam (MD= 7,12; 95%BI 1,08 tot 15,32).
Lorazepam plus haloperidol versus placebo plus haloperidol
Hui et al. vonden geen statistisch significant verschil tussen haloperidol plus lorazepam en haloperidol gecombineerd met een placebo behandeling wanneer een behandeling met haloperidol alleen onvoldoende effect heeft. Het effect op symptomen van delier na 24 uur was een gemiddeld verschil van 2,10 (95%BI -1,00 tot 5,20). De combinatietherapie gaf mogelijk meer bijwerkingen (MD=0,70; 95%BI 0,19 tot 2,63).
Wel werden er aanwijzingen gevonden dat haloperidol plus lorazepam symptomen van agitatie vermindert wanneer een behandeling met haloperidol alleen onvoldoende effect heeft. Er werd een gemiddeld verschil gevonden van 1,90 (95%BI 0,90 tot 2,80).
Haloperidol versus chloorpromazine
Breitbart et al. onderzochten ook het effect van haloperidol versus chloorpromazine. Er werd geen statistisch significant verschil gemeten tussen haloperidol en chloorpromazine met betrekking tot het effect op symptomen van delier na 48 uur (MD=0,37, 95%BI -4,58 tot 5,32) of het optreden van bijwerkingen (MD=0,46; 95%BI -4,22 tot 5,14).
Haloperidol versus lorazepam
Breitbart et al. onderzochten ook het effect van haloperidol versus lorazepam. Er werd geen statistisch significant verschil gemeten tussen haloperidol en lorazepam met betrekking tot het effect op symptomen van delier na 48 uur (MD= -4,88; 95%BI -9,70 tot 0,06) of het optreden van bijwerkingen (MD= -6,66; 95%BI -14,85 tot 1,53).
Haloperidol
Effectiviteit
|
Zeer laag |
Het is onduidelijk wat het verschil tussen haloperidol, risperidon en een placebobehandeling is bij het behandelen van delirante symptomen dan haloperidol voor patiënten met een delier in de palliatieve fase.
Agar et al. 2017 |
|
Zeer laag |
Het is onduidelijk wat het verschil is tussen haloperidol versus olanzapine in het behandelen van delirante symptomen bij patiënten in de palliatieve fase.
Lin et al. 2008; Van der Vorst et al. 2020 |
Bijwerkingen
|
Laag |
Er zijn aanwijzingen dat haloperidol even veel bijwerkingen geeft als andere medicamenteuze interventies in het behandelen van delirante symptomen bij patiënten in de palliatieve fase. Er zijn aanwijzingen dat patiënten die palliatieve zorg krijgen en haloperidol krijgen ter behandeling van delirante symptomen vaker bijwerkingen ervaren dan patiënten die een placebobehandeling krijgen.
Finucane et al. 2020; Barbateskovic et al. 2019; Van der Vorst et al. 2020 |
Cognitieve status
|
Zeer laag |
Het zou kunnen zijn dat haloperidol een klein positief voordeel heeft op de cognitieve functie van patiënten met een delier in de palliatieve fase ten opzichte van lorazepam en even groot effect heeft als chloorpromazine.
Breitbart et al. 1996 |
Kwaliteit van leven
|
Laag |
Er zijn aanwijzingen dat haloperidol even effectief zou kunnen zijn als olanzapine op de kwaliteit van leven van patiënten met een delier in de palliatieve fase.
Van der Vorst et al. 2020 |
Mortaliteit
|
Zeer laag |
Het is onduidelijk wat het verschil is in mortaliteit tussen haloperidol en andere medicatie bij de behandeling delirante symptomen van patiënten in de palliatieve fase.
Barbateskovic et al. 2019 |
Overige uitkomstmaten
|
Geen GRADE |
Er zijn geen studies gevonden waarin het effect van haloperidol op het gebruik van reddingsmedicatie, functionele status, kwaliteit van sterven is onderzocht bij patiënten met een delier in de palliatieve fase. |
Rivastigmine
Effectiviteit
|
Zeer laag |
Het zou kunnen dat een placebobehandeling plus haloperidol effectiever zou kunnen zijn in het behandelen van delirante symptomen dan rivastigmine plus haloperidol voor ernstig zieke patiënten met een delier.
Van Eijk et al. 2010 |
Mortaliteit
|
Zeer laag |
Het zou kunnen dat mortaliteit hoger is wanneer ernstig zieke patiënten met delirante symptomen behandeld worden met rivastigmine met haloperidol ten opzichte van placebobehandeling met haloperidol.
Van Eijk et al. 2010 |
Overige uitkomstmaten
|
Geen GRADE |
Er zijn geen studies gevonden waarin het effect van rivastigmine op het aantal bijwerkingen, gebruik van reddingsmedicatie, cognitieve status, functionele status, kwaliteit van leven, kwaliteit van sterven of overleving is onderzocht bij patiënten met een delier in de palliatieve fase. |
Kwaliteit van het bewijs
De algehele kwaliteit van het bewijs ten aanzien van de effectiviteit en risico’s van medicamenteuze behandeling van delier bij patiënten die ernstig ziek zijn of palliatieve zorg krijgen, is laag. Enkele beschikbare studies gebruiken ten opzichte van de Nederlandse praktijk een hogere dosering of de dosering wordt sneller verhoogd. Daarmee zijn de uitkomsten ook minder bruikbaar. Er zijn weinig studies uitgevoerd in deze populatie, terwijl de studies die bekend zijn beperkingen laten zien in de onderzochte uitkomstmaten en schadelijkheid.
Balans tussen de voor- en nadelen
Medicamenteuze behandeling kan mogelijk bijdragen aan het verbeteren van symptomen van een delier, maar neemt niet de factoren weg die het delier veroorzaken. Daarnaast kunnen er bijwerkingen optreden zoals apathie, sedatie, vermindering van cognitie, extrapiramidale verschijnselen en/of een averechtse werking op de symptomen van het delier met toename van bijvoorbeeld onrust en agitatie.
De studie van Agar et al. (2017) vond een niet-statistisch significant voordeel van placebo ten opzichte van haloperidol. In het onderzoek werden patiënten na diagnose direct medicamenteus behandeld en daarnaast kregen zij niet-medicamenteuze behandelingen. Dit benadrukt het belang dat niet-medicamenteuze behandeling het uitgangspunt is en indien daarmee onvoldoende effect wordt verkregen een medicamenteuze behandeling kan worden ingezet.
Professioneel perspectief
In deze module wordt de bewijskracht verder uitgewerkt ter onderbouwing van de aanbevelingen die gedaan worden over medicamenteuze behandeling van een delier in de palliatieve fase. Voordat overgegaan wordt tot medicamenteuze interventies zal eerst ingezet moeten worden op de niet-medicamenteuze interventies. De behandeling van een delier in de palliatieve fase is complex, vanwege de (vaak meerdere en deels onoplosbare) onderliggende somatische problemen. Wanneer psychotische klachten (wanen en hallucinaties) en verstoord bewustzijn verbeteren, krijgt een patiënt weer grip op de eigen situatie waardoor de kwaliteit van leven toeneemt en de mogelijkheid tot een waardig afscheid kan herstellen.
Er spelen vaak meerdere onderliggende/onderhoudende oorzaken een rol bij het ontstaan en aanhouden van een delirant beeld in de palliatieve fase. Zoveel mogelijk dienen deze onderhoudende oorzaken tegelijkertijd behandeld of gecorrigeerd te worden (zie module Behandeling van veel voorkomende oorzaken van een delier). Dit zal in ongeveer de helft van de gevallen het delier doen herstellen. Niet alle oorzaken zullen echter behandelbaar (kunnen) zijn.
De voorkeur voor symptomatische behandeling gaat uit naar niet-medicamenteuze behandeling (zie module in de richtlijn ‘Delier bij volwassenen en ouderen’ en module Preventie). Deze aanbevelingen gelden niet alleen voor patiënten in een intramurale setting maar ook voor patiënten in extramurale setting. Bij onvoldoende effect kan medicamenteuze behandeling worden ingezet om het lijden voor patiënt en omgeving te verminderen en dragelijk te maken. Tevens om eventuele gevaarlijke situaties (bijvoorbeeld valgevaar door onrust of agressief gedrag voortkomend uit het delier) onder controle te krijgen. Om deze reden is de werkgroep van mening dat medicamenteuze behandeling (ondanks het gebrek aan evidentie) altijd moet worden overwogen. Daar waar geen onderzoek is verricht, reflecteren de aanbevelingen de mening en klinische ervaring van de werkgroep. Over het algemeen wordt de medicamenteuze behandeling met lagere doseringen ingezet dan gebruikelijk is bij psychotische stoornissen.
Bij een medicamenteuze behandeling van symptomen van een delier in de palliatieve fase dienen de effecten (werking versus bijwerking) hiervan goed gemonitord te worden. Wees hierbij alert op eventuele relevante bijwerkingen. In het kader van delierbehandeling is QT-problematiek bijvoorbeeld minder relevant. Daarnaast kunnen er interacties met andere medicaties optreden. Gebruik voor meer informatie bij de behandeling van ouderen bijvoorbeeld de Ephor website (Expertisecentrum Pharmacotherapie bij OudeRen) of consulteer laagdrempelig een deskundige in het eigen netwerk, of anders een intramuraal of regionaal consultatieteam palliatieve zorg voor deskundig advies (consultatiedienst palliatieve zorg landelijk en per regio).
Haloperidol is geïndiceerd bij psychotische (wanen en hallucinaties) klachten en/of forse onrust. Er is echter één studie van Agar (2017) die de effectiviteit van haloperidol bij een delier in twijfel trekt, aangezien haloperidol minder effectief leek te zijn dan placebo. De kwaliteit van het bewijs is laag, de doseringen van de haloperidol waren laag, de studie beperkte zich van mild tot matig ernstig delier. Klinische ervaring laat zien dat het wel kan bijdragen. Daarom is toch gekozen om dit middel aan te bevelen als eerste keuze, tenzij er sprake is van ziekte van Parkinson, hypokinetisch rigide syndroom of Lewy Body Dementie. Als alternatief kan gekozen worden voor een atypisch antipsychoticum zoals risperidon (niet bij ziekte van Parkinson, hypokinetisch rigide syndroom of Lewy Body Dementie). Wanneer er al een antipsychoticum gegeven wordt in verband met een psychiatrische stoornis wordt niet gestart met haloperidol, maar de dosis van dat antipsychoticum opgehoogd op geleide van symptomen.
Het gebruik van olanzapine strekt in principe niet tot de aanbeveling. Er is geen evidentie dat dit effectiever is dan haloperidol terwijl olanzapine wel vanwege de metabole werking negatieve effecten kan geven, anticholinerge werking. In de klinische praktijk blijkt bij aanwezigheid van EPS/bijwerkingen bij gebruik van haloperidol, dat olanzapine overwogen kan worden, mits er geen aanwijzingen zijn voor ziekte van Parkinson, hypokinetisch rigide syndroom of Lewy Body dementie. Indien haloperidol onvoldoende effect heeft en/of er sprake is van heftige angst/agitatie kan ervoor gekozen worden om tijdelijk kortwerkende benzodiazepines toe te voegen. Als dit een goed effect heeft kan overwogen worden om op een langer werkend middel over te gaan zoals lorazepam of oxazepam. Deze middelen hebben als voordeel dat ze minder vaak toegediend hoeven te worden. Bij blijvende klachten kan een deskundige in het eigen netwerk, het intramurale netwerk (bij een in het ziekenhuis opgenomen patiënt) of het regionaal consultatieteam palliatieve zorg (consultatiedienst palliatieve zorg landelijk en per regio) worden geconsulteerd.
Rivastigmine is met name effectief bij cognitieve achteruitgang en/of een dementieel ziektebeeld, vooral bij Lewy Body Dementie en dementie bij ziekte van Parkinson. Rivastigmine heeft in de praktijk een goed effect op aandachtsstoornissen en perceptieve stoornissen bij patiënten met Lewy Body Dementie, ziekte van Parkinson [McKeith, 2000] en bij een delier. Behandeling van een delier met rivastigmine is nog onvoldoende onderzocht (beschikbare studies zijn case reports, een enkele cohortstudie en een prospectief RCT). Rivastigminebehandelingen vergen variabel noodzakelijke doseringen vanwege de individuele grote verschillen in effecten. Casestudies zijn imponerend door het (vrijwel) complete herstel van (ernstige) delieren van diverse etiologieën [Fischer, 2001; Dautzenberg, 2003; Kalisvaart, 2004]. Opvallend in deze studies was dat lagere rivastigmine doseringen dezelfde effecten hebben als hogere, maar minder vervelende bijwerkingen tot gevolg hadden. Door snel ophogen van de dosis rivastigmine wordt de noodzaak langere tijd te moeten wachten voor het stijgen van de hoeveelheid acetylcholine in de hersenen verontachtzaamd, ook al doordat desensibisering bij hogere doseringen eerder optreedt. Het risico op hogere meer schadelijke doseringen is zeldzaam wanneer de dosering langzaam en gecontroleerd wordt opgehoogd. In twee open cohortstudies in 2004 werd aangetoond dat rivastigminebehandeling preventief effect kan hebben op de frequentie en ernst van delierepisodes. In de prospectieve cohortstudie bij 247 patiënten met vasculaire dementie werd de groep patiënten met een preventieve behandeling rivastigmine vergeleken met de groep patiënten die aspirine kreeg [Moretti, 2004]. In de retrospectieve cohortstudie werd ditzelfde beschermende effect ook gezien als rivastigmine gebruikers met dementie vergeleken werden met niet rivastigmine gebruikers [Dautzenberg, 2004].
Ook in het in 2010 verrichte prospectief dubbelblind gerandomiseerd gecontroleerde onderzoek van Overschott bleek dat alle patiënten die rivastigmine in een dosering van 1,5mg per dag (na 1 week maximaal te verhogen tot maximaal 2x1,5mg per dag) vroegtijdig gestart kregen ter preventie/behandeling van een delier symptoomvrij waren na deze behandeling. Dit was maar bij 3 van de 7 patiënten die een placebo kregen. Onderzoekers, die geblindeerd waren voor de gegeven behandelingen konden (terecht) vertellen of de patiënt een placebo of rivastigmine hadden gekregen, zo groot was de verlichting van symptomen.
Op grond van het weinige onderzoek adviseert de werkgroep om bij overweging van rivastigmine als delierbehandeling bij patiënten in de palliatieve fase een expert te raadplegen. Goede patiëntselectie en conservatief doseren vraagt immers om extra expertise [Dawson, 2015]. Het is over het algemeen belangrijk om bijwerkingen enkele dagen te detecteren en te monitoren. De behandeling moet worden afgebouwd of gestopt indien er sprake is van remissie.
Subgroepen
Ziekte van Parkinson, hypokinetisch rigide syndroom, Lewy Body Dementie
Bij patiënten met ziekte van Parkinson, hypokinetisch rigide syndroom en Lewy Body Dementie is de kans groot dat zij averechts reageren of ernstige bijwerkingen ontwikkelen op zowel een klassiek antipsychoticum zoals haloperidol als op een atypisch antipsychoticum, zoals risperidon of olanzapine. Daarom wordt voor deze patiëntengroepen aangeraden om te behandelen met clozapine. De dosering van clozapine moet worden aangepast op basis van leeftijd en co-morbiditeit. Bij de start met clozapine zal tijdens het opbouwen wekelijks leucocytencontrole moeten plaatsvinden (dit kan eventueel via een vingerprik). In de praktijk blijkt echter dat het niet altijd mogelijkheid is bloed af te nemen, ook indien de prognose heel slecht is kan in die gevallen hier beargumenteerd van afgeweken worden (zie Richtlijn voor het gebruik van Clozapine « Clozapinepluswerkgroep). Alleen wanneer er een duidelijke contra-indicatie bestaat voor het toedienen van clozapine oraal, kan quetiapine worden overwogen. Quetiapine dient geleidelijk opgebouwd te worden vanaf 12.5 mg dd tot gewenste effect bereikt wordt (max. 200 mg volgens de richtlijn ziekte van Parkinson). In lagere doseringen is het effect vooral sederend. Rivastigmine kan overwogen worden indien andere behandelingen onvoldoende effectief zijn of wanneer er bijwerkingen optreden. Rivastigmine lijkt in de klinische praktijk goed te werken bij ziekte van Parkinson en mogelijk ook bij Alzheimer dementie als er visuele hallucinaties aanwezig zijn. Verder blijkt vanuit de klinische ervaring dat rivastigmine al binnen een aantal dagen een gunstig effect kan hebben. Positieve studies naar de toepassing van rivastigmine binnen deze setting ontbreken echter. Ook hier geldt dat daar waar geen onderzoek is verricht, de aanbevelingen de mening en klinische ervaring van de werkgroep reflecteren.
Onttrekkingsdelier
Bij plots staken van middelen als benzodiazepines, alcohol of drugs kan er toename ontstaan van onrust en agitatie als gevolg van een onttrekkingsdelier. De werkgroep verwijst voor adequate behandeling naar de apart module ‘onttrekkingsdelier’ in de richtlijn Delier bij volwassenen en ouderen NVKG (2020).
Perspectief van patiënten
Het doel van de behandeling is het lijden van de patiënt in de palliatieve fase te beperken. Er is voor de modules over zorg in de palliatieve fase bij aanwezigheid van een delier geen apart onderzoek gedaan naar de voorkeuren van patiënten en naasten. Aangenomen wordt dat het voor alle patiënten van belang is dat het delier behandeld wordt. Rapport van het patiënten panel (niet gepubliceerd) van de Patiëntenfederatie Nederland ‘Ervaringen rondom een delier’ [Patiëntenfederatie Nederland, 2020] wijst uit dat de voorkeur uitgaat naar niet-medicamenteuze interventies. Naasten zijn vaak ambivalent over het starten van medicatie en dienen daarom betrokken te worden in deze beslissing.
Aanvaardbaarheid en haalbaarheid
In de geïncludeerde studies werd geen inzicht gegeven in de kosten(effectiviteit) van de behandeling. De inschatting van de werkgroep is dat het werkingsmechanisme van medicamenteuze behandeling verschillend is en dat kosten daarom geen relevante rol spelen in het aanwijzen van een voorkeursbehandeling. Bovendien zijn er geen grote verschillen in de kosten van de genoemde middelen.
Agar, Meera R., Peter G. Lawlor, Stephen Quinn, Brian Draper, Gideon A. Caplan, Debra Rowett, Christine Sanderson, et al. 2017. “Efficacy of Oral Risperidone, Haloperidol, or Placebo for Symptoms of Delirium among Patients in Palliative Care: A Randomized Clinical Trial.” JAMA Internal Medicine 177 (1): 34–42. https://doi.org/10.1001/jamainternmed.2016.7491.
Atalan, Nazan, Meltem Efe Sevim, Serdar Akgün, Osman Fazlioǧullari, and Cem Başaran. 2013. “Morphine Is a Reasonable Alternative to Haloperidol in the Treatment of Postoperative Hyperactive-Type Delirium after Cardiac Surgery.” Journal of Cardiothoracic and Vascular Anesthesia 27 (5): 933–38. https://doi.org/10.1053/j.jvca.2013.01.017.
Bakri, MH, EA Ismail, and A Ibrahim. 2015. “Comparison of Dexmedetomidine or Ondansetron with Haloperidol for Treatment of Postoperative Delir- Ium in Trauma Patients Admitted to Intensive Care Unit: Randomized Controlled Trial.” Anaesth, Pain & Intensive Care 19 (2): 118–23.
Barbateskovic, Marija, Sara R. Krauss, Marie O. Collet, Nina C. Andersen-Ranberg, Ole Mathiesen, Janus C. Jakobsen, Anders Perner, and Jørn Wetterslev. 2020. “Haloperidol for the Treatment of Delirium in Critically Ill Patients: A Systematic Review with Meta-Analysis and Trial Sequential Analysis.” Acta Anaesthesiologica Scandinavica. Blackwell Munksgaard. https://doi.org/10.1111/aas.13501.
Breitbart, William, Rocco Marotta, Meredith M. Platt, Henry Weisman, Maria Derevenco, Carmen Grau, Kathy Corbera, Susan Raymond, Stephen Lund, and Paul Jacobsen. 1996. “A Double-Blind Trial of Haloperidol, Chlorpromazine, and Lorazepam in the Treatment of Delirium in Hospitalized AIDS Patients.” American Journal of Psychiatry 153 (2): 231–37.
Dautzenberg PLJ, Wouters CJ. Rivastigmine in prevention of delirium in a 65 years old man with Parkinson’s disease. Int J Geriatr Psychiatry 2003; 18: 555-558.
Dautzenberg PLJ, Mulder LJ, Olde Rikkert MGM, Wouters CJ, Loonen AJM. Delirium in elderly hospitalized patients: protective effects of chronic rivastigmine usage. Int J Geriatr Psychiatry 2004; 19: 641-644.
Dawson AH, Buckley NA. Pharmacological management of anticholinergic delirium theory, evidence and practice. British Journal of Clinical Pharmacology 2015; 81(3):516-524.
Finucane, Anne M., Louise Jones, Baptiste Leurent, Elizabeth L. Sampson, Patrick Stone, Adrian Tookman, and Bridget Candy. 2020a. “Drug Therapy for Delirium in Terminally Ill Adults.” Cochrane Database of Systematic Reviews.
Fischer P. Successful treatment of nonanticholinergic delirium with a cholinesterase inhibitor. J Clin Psychopharmacol 2001; 21(1): 118.
Girard, Timothy D., Matthew C. Exline, Shannon S. Carson, Catherine L. Hough, Peter Rock, Michelle N. Gong, Ivor S. Douglas, et al. 2018. “Haloperidol and Ziprasidone for Treatment of Delirium in Critical Illness.” New England Journal of Medicine 379 (26): 2506–16. https://doi.org/10.1056/nejmoa1808217.
Han, Chang Su, and Yong Ku Kim. 2004. “A Double-Blind Trial of Risperidone and Haloperidol for the Treatment of Delirium.” Psychosomatics 45 (4): 297–301. https://doi.org/10.1016/S0033-3182(04)70170-X.
Hui, David, Susan Frisbee-Hume, Annie Wilson, Seyedeh S. Dibaj, Thuc Nguyen, Maxine de La Cruz, Paul Walker, et al. 2017. “Effect of Lorazepam with Haloperidol vs Haloperidol Alone on Agitated Delirium in Patients with Advanced Cancer Receiving Palliative Care: A Randomized Clinical Trial.” JAMA - Journal of the American Medical Association 318 (11): 1047–56. https://doi.org/10.1001/jama.2017.11468.
Kalisvaart CJ, Boelaarts I, de Jonghe JFM, Hovinga IM, Kat MG. Succesvolle behandeling van 3 langdurig delirante oudere patiënten met de cholinesteraseremmer rivastigmine. Ned Tijdschr Geneeskd 2004; 148(30): 1501-1504.
Lin, CJ, FJ Sun, F Chun-Kai, HW Chen, and Yl Lai. 2008. “An Open Trial Comparing Haloperidol with Olanzapine for the Treatment of Delirium in Palliative and Hospice Center Cancer Patients.” Journal of Internal Medicine of Taiwan 19 (4): 346–54.
McKeith I et al. Efficacy of rivastigmine in dementia with Lewy bodies: a randomised, double-blind, placebo-controlled international study. Lancet 2000; 356: 2031-2036.
Moretti R, Torre P, Antonello RM, Cattaruzza T, Cazzato G. Cholinesterase inhibition as a possible therapy for delirium in vascular dementia: A controlled, open 24-month study of 246 patients. American Journal of Alzheimer’s Disease and Other Dementias 2004; 19(6): 333-339.
ORIC-I. n.d. “Optimizing Recovery from Intensive Care: Mechanical Ventilation and Delirium.” Https://Clinicaltrials.Gov/Ct2/ Show/NCT00300391?Term=oric-I&rank=1.
Overschott R, Vernon M, Morris J, Burns A. Rivastigmine in the treatment of delirium in older people: a pilot study. International Psychogeriatrics. 2010; 22:5; 812-818.
Patiëntenfederatie Nederland. 2020. ‘Ervaringen rondom een delier’. Utrecht. Opvraagbaar.
Skrobik, Yoanna K., Nicolas Bergeron, Marc Dumont, and Stewart B. Gottfried. “Olanzapine vs Haloperidol: Treating Delirium in a Critical Care Setting.” Intensive Care Medicine. 2004; 30(3): 444–49. https://doi.org/10.1007/s00134-003-2117-0.
Tagarakis, Georgios I., Christos Voucharas, Fani Tsolaki, Marios E. Daskalopoulos, Vassilios Papaliagkas, Charalampos Parisis, Eleni Gogaki, et al. “Ondasetron versus Haloperidol for the Treatment of Postcardiotomy Delirium: A Prospective, Randomized, Double-Blinded Study.” Journal of Cardiothoracic Surgery. 2012; 7(1). https://doi.org/10.1186/1749-8090-7-25.
Van der Vorst, MJDL, ECW Neefjes, MSA Boddaert, BATT Verdegaal, A Beeker, SCC Teunissen, ATF Beekman, et al. “Olanzapine Versus Haloperidol for Treatment of Delirium in Patients with Advanced Cancer: A Phase III Randomized Clinical Trial.” Oncologist. 2020; 25(3): e570‐e577. https://www.cochranelibrary.com/central/doi/10.1002/central/CN-02101960/full.
